環(huán)狀(circRNA)是一類特殊的共價閉環(huán)RNA分子,,在調(diào)控生理和病理進(jìn)程中,,通過不同的機理發(fā)揮著重要作用,。傳統(tǒng)上,,circRNA被認(rèn)為是一種非編碼RNA(ncRNA),。2014年,在北卡羅來納大學(xué)報導(dǎo)了環(huán)形RNA在細(xì)胞內(nèi)可通過非帽依賴的機理來翻譯蛋白,,人們認(rèn)識到circRNA也具有編碼與表達(dá)蛋白的能力,。此后,隨著體外環(huán)化技術(shù)的發(fā)展,,比線性mRNA穩(wěn)定性更強的合成circRNA成為mRNA治療領(lǐng)域備受關(guān)注的新技術(shù),,有望以mRNA藥物相似的遞送方法,實現(xiàn)疾病的治療,。
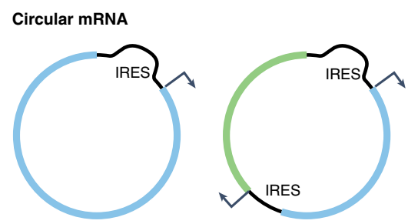
圖1 環(huán)狀RNA結(jié)構(gòu)
一,、circRNA的特點
1、強穩(wěn)定性:與線性RNA相比,,circRNA的主要優(yōu)勢就是其環(huán)狀結(jié)構(gòu)提高了穩(wěn)定性,。因為circRNA中5’和3’末端的缺失使其具有外切酶抗性,,不能通過典型的RNA降解途徑降解,需要通過核酸內(nèi)切酶線性化后將其降解(圖2,,a-c),,因此,具有更高的體內(nèi)穩(wěn)定性,,半衰期更長,。
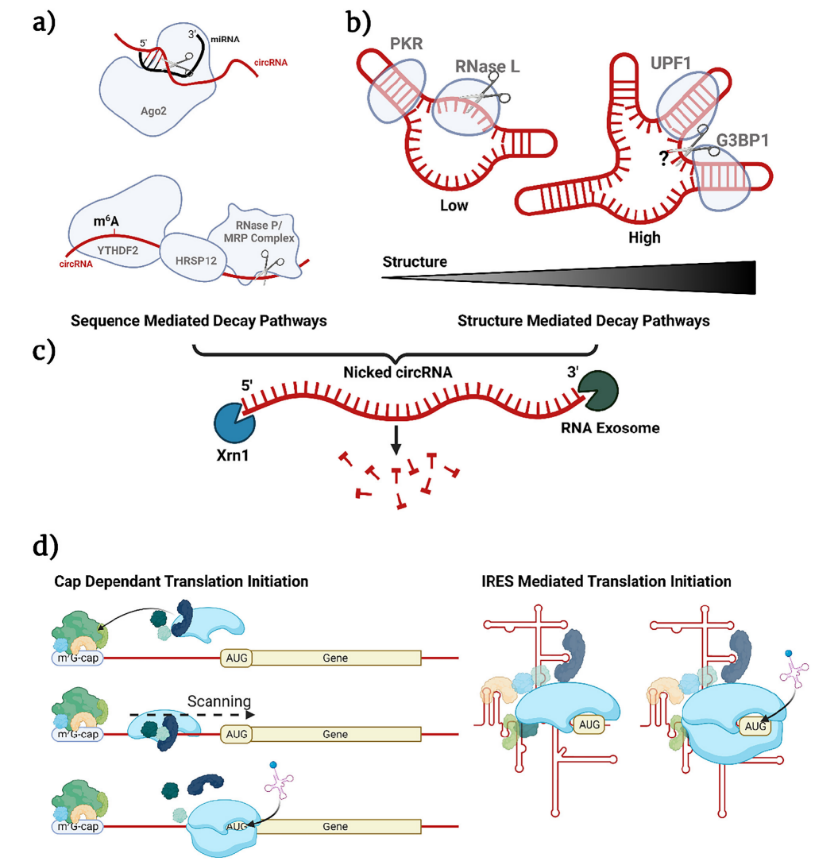
圖2 circRNA的降解和翻譯
2、非帽依賴性翻譯:大多數(shù)真核生物mRNA的翻譯起始于5’端,,以典型的帽(7GpppN)依賴方式進(jìn)行(圖2,,d),由于步驟復(fù)雜且需要招募較多起始因子,,該過程具有高能量消耗的特點,,因此,當(dāng)機體處于病毒感染或疾病等細(xì)胞應(yīng)激的不利條件下,,該典型翻譯起始將被整體抑制,,以確保細(xì)胞響應(yīng)應(yīng)激并存活。那么當(dāng)?shù)湫头g機制下調(diào)時,,維持細(xì)胞生存所需要的關(guān)鍵蛋白的產(chǎn)生就需要另一套非典型翻譯機制,,即非帽依賴性翻譯—通過內(nèi)部核糖體進(jìn)入位點(IRES)來驅(qū)動,而這種非帽機制正適合無5’端的circRNA,,已知IRES是circRNA主要的翻譯方式,。換言之,在疾病治療過程中,,當(dāng)機體處于ER應(yīng)激,、遺傳毒性應(yīng)激、缺氧,、營養(yǎng)剝奪,、體溫過低、體溫過高或感染狀態(tài)下,,帽依賴性翻譯起始被抑制,,線性mRNA無法有效翻譯,基于mRNA的藥物療效降低,,而circRNA可憑借非帽依賴性翻譯的機制優(yōu)勢,,保證蛋白質(zhì)的正常翻譯,保證藥物療效,。
3,、多順反子表達(dá):多順反子表達(dá)是指從單個mRNA分子中翻譯兩個或多個獨立的基因。對于多順反子線性mRNA,,5’cap比IRES的表達(dá)更高,,導(dǎo)致蛋白表達(dá)比例不均,。而對于circRNA,通過引入多個IRES-ORF,,有可能達(dá)到接近化學(xué)計量的多順反子表達(dá),,因為所有編碼的蛋白質(zhì)都具有相同的翻譯起始機制。雖然這一點尚未得到證實,,但circRNA的多順反子表達(dá)可能有益于多組分蛋白質(zhì)療法,,其中蛋白質(zhì)復(fù)合物組分的受控比例至關(guān)重要。
4,、免疫原性低:線性RNA通過病原體識別受體(如RIG-I,、TLR3、TLR7,、TLR8等)刺激先天免疫,,導(dǎo)致干擾素反應(yīng),進(jìn)而對其翻譯及應(yīng)用造成了負(fù)面影響,;而純的circRNA并不存在RIG-I,、TLR3、 TLR7及TLR8的識別序列,,這種“免疫沉默(immunosilent)”可以使其更有效地表達(dá)蛋白質(zhì),,而沒有抑制性干擾素反應(yīng),。此外,,先天免疫系統(tǒng)激活減少限制了樹突狀細(xì)胞的活化和成熟,有助于防止對編碼的治療蛋白產(chǎn)生免疫力,。
二,、circRNA的應(yīng)用
1、蛋白質(zhì)替代療法
蛋白質(zhì)替代療法的目的是恢復(fù)那些缺失或有缺陷的蛋白質(zhì)功能,,通常是由基因突變導(dǎo)致,。采用mRNA治療內(nèi)源蛋白缺失已應(yīng)用于多種疾病
相對于mRNA,circRNA在蛋白替代療法的應(yīng)用中具有諸多優(yōu)勢,,如結(jié)構(gòu)具有更高的穩(wěn)定性,,蛋白質(zhì)表達(dá)時間更長;具有與線性RNA相似的蛋白表達(dá)峰值,,但下降率較低,。這些優(yōu)勢使得circRNA可以產(chǎn)生較高的蛋白質(zhì)累積并持續(xù)較長時間;減少給藥頻率,,且免疫原性較低,。
2、疫苗
mRNA疫苗具有高效,、研發(fā)周期短,、模塊化生產(chǎn),、低成本等優(yōu)勢,已是通用的疫苗種類,,尤其在應(yīng)對新冠等突發(fā)流行病,,其極快的研發(fā)制造能力,優(yōu)勢極為顯著,。同時,,在面對病毒變異方面,多價mRNA疫苗的易得性可及時提供針對多種病原體的保護(hù),,意義重大,。
另外,mRNA疫苗的自佐劑效應(yīng)也為疫苗保護(hù)性免疫的誘導(dǎo)提供了支持,。在機制上,,mRNA會引起與病毒免疫相關(guān)的Th1偏向免疫應(yīng)答,誘導(dǎo)對T細(xì)胞擴(kuò)增和免疫記憶形成至關(guān)重要的I型干擾素反應(yīng),,對病毒預(yù)防極有幫助,。不過該機制同時也限制了mRNA的帽依賴性翻譯起始,影響表達(dá)效率,。那么circRNA所使用的非帽依賴性起始機制,,例如不受干擾素抑制的IRES,是一種有吸引力的替代方案,。在保持circRNA抗原表達(dá)穩(wěn)定的同時,,更有效地誘導(dǎo)干擾素反應(yīng),可能會進(jìn)一步增強疫苗的保護(hù)作用,。
疫苗接種的目標(biāo)是誘導(dǎo)強烈的適應(yīng)性免疫反應(yīng)和長期免疫記憶,。適應(yīng)性免疫記憶的誘導(dǎo)部分取決于抗原暴露的持續(xù)時間。因此,,RNA編碼抗原的長期表達(dá)可以更有效地引發(fā)具有持久免疫記憶的免疫反應(yīng) ,。與mRNA相比,circRNA固有的穩(wěn)定性延長了蛋白質(zhì)翻譯的時間,,增加了體內(nèi)的蛋白質(zhì)產(chǎn)量,,長期表達(dá)抗原可以更有效地誘導(dǎo)具有持久免疫記憶的免疫反應(yīng)。
3,、癌癥免疫療法
癌癥免疫治療采用機體免疫的作用成分如細(xì)胞因子,、抗體和免疫細(xì)胞等進(jìn)行癌癥的治療?;赗NA的免疫治療可以通過將癌癥新抗原編碼為疫苗,、免疫刺激細(xì)胞因子、抗體和免疫細(xì)胞受體實現(xiàn),,具有靈活性及多功能性,。此外,,還可以通過非病毒載體以mRNA直接轉(zhuǎn)染T細(xì)胞,在體原位生產(chǎn)CAR-T細(xì)胞,,避免了傳統(tǒng)CAR-T細(xì)胞制造的缺點,。
circRNA在癌癥免疫治療中有幾個優(yōu)勢:
1)與mRNA相同,circRNA既可應(yīng)用于腫瘤個性化治療,,也可同時編碼多種新抗原,,降低癌癥逃逸和復(fù)發(fā)風(fēng)險。對于精準(zhǔn)細(xì)胞治療,,可以通過改變編碼序列輕松定制嵌合抗原受體的circRNA編碼,,并定制以靶向不同類型的癌癥進(jìn)行精準(zhǔn)癌癥免疫治療;
2)circRNA的穩(wěn)定性強,,可以保證抗原蛋白的穩(wěn)定表達(dá),;circRNA癌癥疫苗可以延長抗原呈遞,獲得更強的免疫反應(yīng),;增加免疫刺激蛋白,,如細(xì)胞因子和小抗體片段的表達(dá)時間,可以更好地將免疫細(xì)胞招募到腫瘤部位,;
3)早期研究表明,,修飾mRNA的低免疫原性對腫瘤中的蛋白質(zhì)表達(dá)很重要,因此circRNA固有的較低免疫原性對于腫瘤內(nèi)免疫刺激蛋白表達(dá)更具優(yōu)勢,。未修飾的RNA激活先天免疫系統(tǒng)將降低抗體表達(dá),,阻止適應(yīng)性免疫細(xì)胞有效募集到腫瘤中;
4)由于IRES啟動的非帽依賴性翻譯既可適應(yīng)各種復(fù)雜的腫瘤環(huán)境,,也可抵抗癌細(xì)胞減緩蛋白翻譯并逃逸細(xì)胞因子或抗體免疫治療機制,,增加了不同癌癥治療的一致性,。
4,、基因編輯
在基因編輯方面,基于circRNA的穩(wěn)定性,,首先可應(yīng)用于小的RNA組分,,比如向?qū)NA(adRNA/gRNA),因為在基因編輯系統(tǒng)中的向?qū)NA是最脆弱的,,很容易被核酸酶降解,;其次,circRNA也有望用于編碼基于蛋白質(zhì)的編輯器以進(jìn)行基因編輯,。與mRNA相比,,circRNA提供的穩(wěn)定性和穩(wěn)健表達(dá)可以使Cas9蛋白的持久性更長,增加的蛋白表達(dá)可能會顯著提高基因編輯效率,。
在ADARs介導(dǎo)的RNA編輯中,,2019年,,北京大學(xué)魏文勝課題組曾研發(fā)出了借助gRNA募集ADAR實現(xiàn)RNA精準(zhǔn)編輯的新策略[1]:LEAPER™。LEAPER™通過在細(xì)胞中表達(dá)短工程化的ADAR募集RNA(ADAR-recruiting RNA,,arRNA)來完成ADAR的招募以及RNA編輯,,由于這種技術(shù)彼時尚不成熟,具有一定長度的arRNA可能引起鄰近的堿基的脫靶編輯,。2022年,,魏文勝課題組推出了LEAPER™的升級版本—— LEAPER™ 2.0,設(shè)計并運用了可招募ADAR的環(huán)形RNA(circular ARAR-recruiting RNA,,circ-arRNA)[2],,通過AAV遞送,遺傳編碼的circ-arRNA可以在人的原代細(xì)胞和類器官中實現(xiàn)長時程的RNA編輯,,這種可避免核酸外切酶切割的環(huán)狀RNA進(jìn)一步提升了體外和體內(nèi)編輯的效率和精準(zhǔn)性,,基本清除了雙鏈RNA區(qū)域內(nèi)目標(biāo)轉(zhuǎn)錄本上的脫靶。
5,、非編碼環(huán)狀RNA治療
circRNA在細(xì)胞內(nèi)具有內(nèi)源性非編碼功能,,如miRNA和RNA結(jié)合蛋白海綿功能。circRNA作為調(diào)控RNA,,具有作為miRNA和RNA結(jié)合蛋白的競爭性抑制劑從而進(jìn)行治療的潛力,。不過目前已有研究都處于體外實驗階段,尚未有體內(nèi)數(shù)據(jù),,不過受限于遞送問題,,體內(nèi)模型可能也難以實現(xiàn)。
circRNA是共價封閉的,、高度穩(wěn)定的RNA形式,,具有巨大的治療應(yīng)用潛力。與線性蛋白相比,,circRNA具有穩(wěn)定性和蛋白質(zhì)表達(dá)增強的能力等優(yōu)點,,在疫苗開發(fā)、癌癥免疫治療,、蛋白質(zhì)替代治療和基因編輯方面有著廣闊的可應(yīng)用空間,。總之circRNA在基于RNA的藥物領(lǐng)域是一種有潛力的RNA形式,,有望更新個性化治療手段,。
參考文獻(xiàn)
[1]Yi, Z., Zhu, S., et al. (2019). Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs. Nature biotechnology, 37(9), 1059–1069.
[2] Yi, Z., Qu, L., Tang, H. et al. Engineered circular ADAR-recruiting RNAs increase the efficiency and fidelity of RNA editing in vitro and in vivo. Nat Biotechnol 40, 946–955 (2022).
愛必信標(biāo)準(zhǔn)工具RNA推薦:
貨號 | 產(chǎn)品名稱 | 規(guī)格 |
abs60332 | Endless eGFP mRNA | 100ug |
abs60333 | Endless Fluc mRNA | 100ug |
abs60334 | Endless mcherry mRNA | 100ug |
abs60335 | Endless Cas 9 mRNA | 100ug |
abs60336 | Endless EPO mRNA | 100ug |
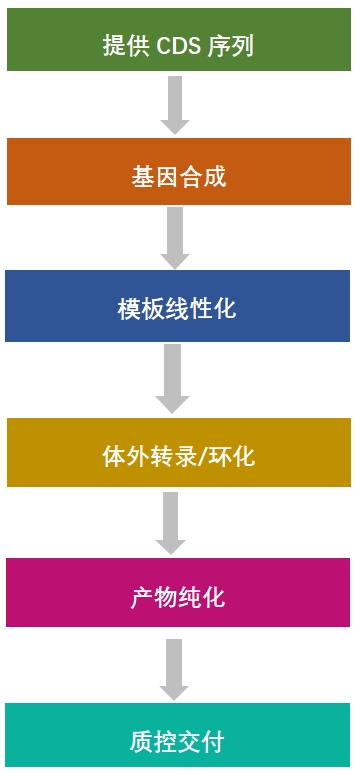
環(huán)狀RNA定制流程:
| 環(huán)狀RNA定制化合成/定制化服務(wù) 服務(wù)參數(shù): 1、min合成量:200ug/條,; 4、標(biāo)準(zhǔn)交付:1.0ug/uL,; 5,、標(biāo)準(zhǔn)質(zhì)控:濃度;純度,; 6,、合成周期:4-8周(定制化合成);6-8周(定制化服務(wù)),。 |
好消息,!Absin文獻(xiàn)獎勵重磅升級!

Absin特色產(chǎn)品線:
WB相關(guān):ECL發(fā)光液,、預(yù)染marker,、預(yù)制膠;IHC相關(guān):二抗試劑盒,、組化筆,;IP/CoIP試劑盒;激動劑/抑制劑,;血清,、BSA、蛋白酶K,、CTB,、TTX、CEE,;凋亡試劑盒,;呼吸爆發(fā)試劑盒;ELISA試劑盒,;重組蛋白,;抗體: 二抗、標(biāo)簽抗體,、對照抗體,;定制服務(wù)(抗體/多肽/蛋白/標(biāo)記/檢測)...
相關(guān)產(chǎn)品
免責(zé)聲明
- 凡本網(wǎng)注明“來源:化工儀器網(wǎng)”的所有作品,,均為浙江興旺寶明通網(wǎng)絡(luò)有限公司-化工儀器網(wǎng)合法擁有版權(quán)或有權(quán)使用的作品,,未經(jīng)本網(wǎng)授權(quán)不得轉(zhuǎn)載、摘編或利用其它方式使用上述作品,。已經(jīng)本網(wǎng)授權(quán)使用作品的,,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:化工儀器網(wǎng)”,。違反上述聲明者,,本網(wǎng)將追究其相關(guān)法律責(zé)任,。
- 本網(wǎng)轉(zhuǎn)載并注明自其他來源(非化工儀器網(wǎng))的作品,目的在于傳遞更多信息,,并不代表本網(wǎng)贊同其觀點和對其真實性負(fù)責(zé),,不承擔(dān)此類作品侵權(quán)行為的直接責(zé)任及連帶責(zé)任。其他媒體,、網(wǎng)站或個人從本網(wǎng)轉(zhuǎn)載時,,必須保留本網(wǎng)注明的作品第一來源,并自負(fù)版權(quán)等法律責(zé)任,。
- 如涉及作品內(nèi)容,、版權(quán)等問題,請在作品發(fā)表之日起一周內(nèi)與本網(wǎng)聯(lián)系,,否則視為放棄相關(guān)權(quán)利,。
 手機版
手機版 化工儀器網(wǎng)手機版
化工儀器網(wǎng)手機版
 化工儀器網(wǎng)小程序
化工儀器網(wǎng)小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關(guān)注視頻號
掃碼關(guān)注視頻號
















 采購中心
采購中心