
癌細(xì)胞為了躲避免疫系統(tǒng)的追殺,,進化出了許多多多多不同的策略來逃逸免疫。近期,,研究揭示了癌細(xì)胞逃避免疫的新策略,!跟小 M 一起來看下吧!
Section.01
線粒體轉(zhuǎn)移的"雙向奔赴"
腫瘤微環(huán)境 (TME) 中的代謝重編程對抗腫瘤免疫反應(yīng)至關(guān)重要,,且線粒體在代謝重編程中起著重要作用,。
先前,Tanmoy Saha 等人研究了癌細(xì)胞和免疫細(xì)胞之間的線粒體運輸[1],,發(fā)現(xiàn)癌細(xì)胞可以通過納米管介導(dǎo)“偷走”免疫細(xì)胞線粒體,。線粒體的丟失和功能障礙導(dǎo)致 T 細(xì)胞衰竭,這是 T 細(xì)胞免疫療法的主要障礙,。不過,,研究人員發(fā)現(xiàn),,骨髓基質(zhì)細(xì)胞 (BMSC) 與 T 細(xì)胞也可建立納米管連接,,并利用其將基質(zhì)細(xì)胞線粒體移植到 CD8+ T 細(xì)胞中,使其變身“T 細(xì)胞”,,介導(dǎo)更強勁的腫瘤消退[2],。
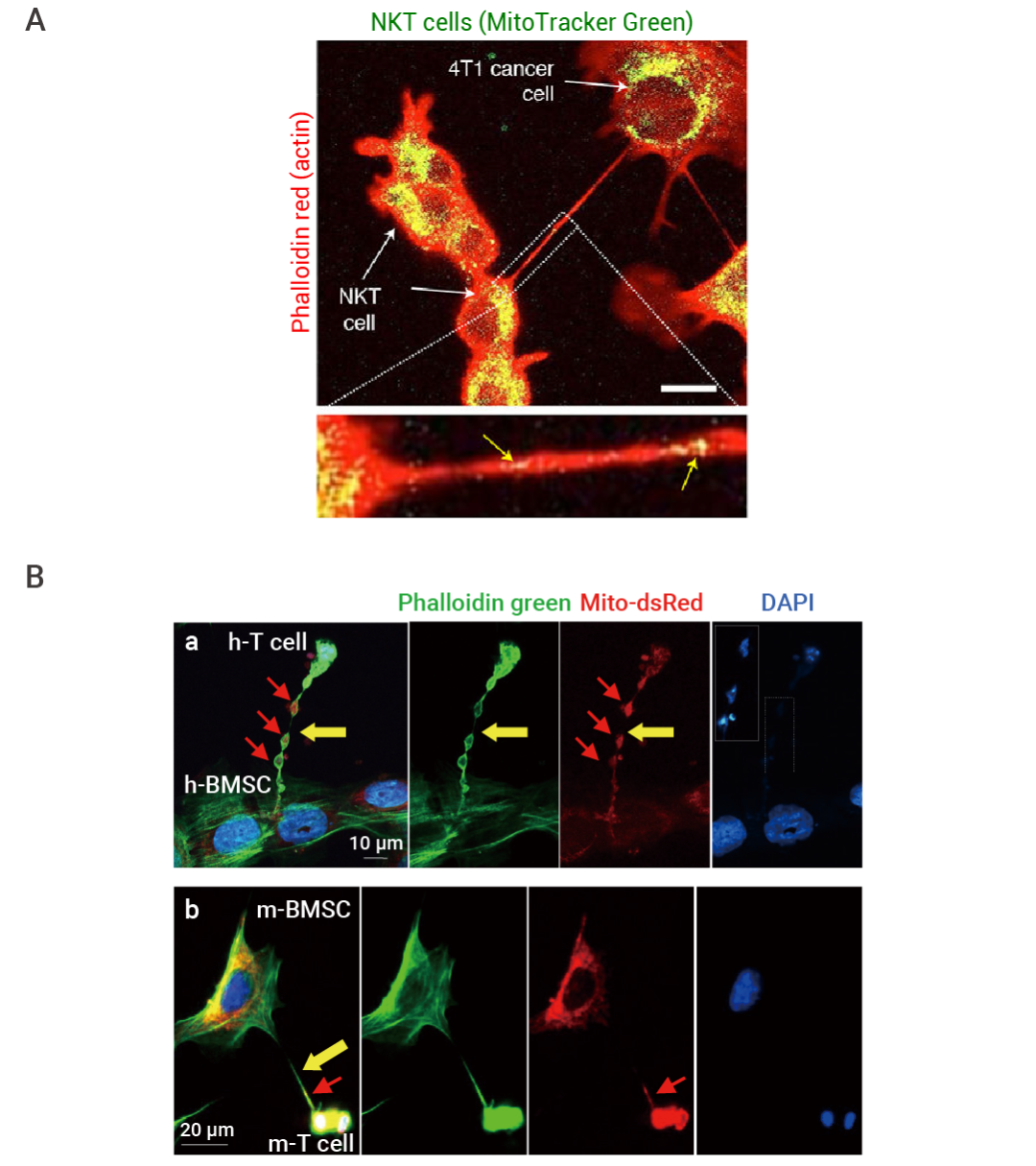
圖 1. 納米管介導(dǎo)線粒體轉(zhuǎn)移[1][2]。
隨著不斷探索,,人們對腫瘤免疫的研究也陸續(xù)有了新進程:從線粒體轉(zhuǎn)移是從免疫細(xì)胞到癌細(xì)胞的單向運輸,到發(fā)現(xiàn)線粒體也可以從癌細(xì)胞轉(zhuǎn)移到 TME 的 T 細(xì)胞中,,形成 ”雙向奔赴”,。然而,,這一過程的發(fā)生與腫瘤免疫之間的影響尚不清楚[3]。
Section.02
Nature 發(fā)文:
mtDNA 功能再升級,!
近期,,Nature 刊發(fā)日本千葉癌癥研究中心等團隊的重磅研究,揭示腫瘤細(xì)胞通過線粒體向 T 細(xì)胞傳遞突變的線粒體 DNA (mtDNA),,導(dǎo)致 T 細(xì)胞代謝異常,、功能衰竭,進而逃避免疫攻擊的全新機制[4],。這一發(fā)現(xiàn)為理解腫瘤免疫逃逸提供了全新視角,,并為逆轉(zhuǎn)免疫治療耐藥提供了潛在靶點。
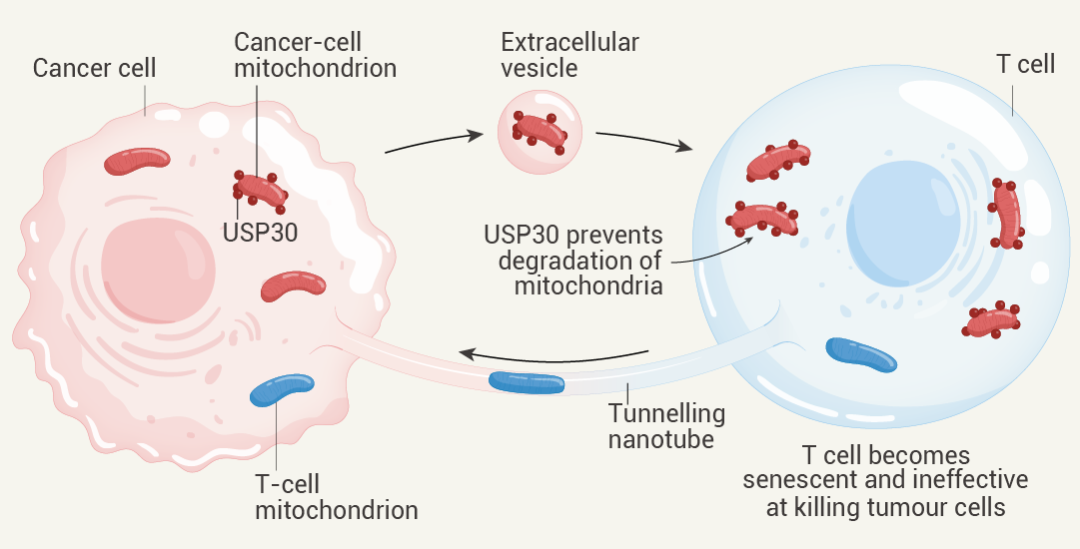
圖 2. 線粒體在細(xì)胞間的雙向轉(zhuǎn)移[5],。
具體來說,,Ikeda 等人研究了線粒體在癌細(xì)胞和免疫系統(tǒng) T 細(xì)胞之間的轉(zhuǎn)移,研究對象包括小鼠和人類細(xì)胞,。作者報告稱,,T 細(xì)胞通過一種名為隧道納米管的結(jié)構(gòu)將線粒體轉(zhuǎn)移到癌細(xì)胞中。作為交換,,癌細(xì)胞通過釋放細(xì)胞外囊泡將線粒體轉(zhuǎn)移到 T 細(xì)胞中,,這些囊泡會被細(xì)胞吸收。這些來自癌細(xì)胞的線粒體被 USP30 蛋白包裹,,這種蛋白可以防止線粒體降解,。這使得癌細(xì)胞的線粒體能夠取代 T 細(xì)胞的線粒體。T 細(xì)胞進入一種稱為衰老的生長停滯狀態(tài),,從而削弱其殺死癌細(xì)胞的能力[5],。
研究人員從黑色素瘤和非小細(xì)胞肺癌 (NSCLC) 患者的腫瘤組織中分離腫瘤浸潤淋巴細(xì)胞 (TILs),通過全 mtDNA 測序鑒定突變,,鑒定出 TILs 與腫瘤細(xì)胞的 mtDNA 共享突變,。
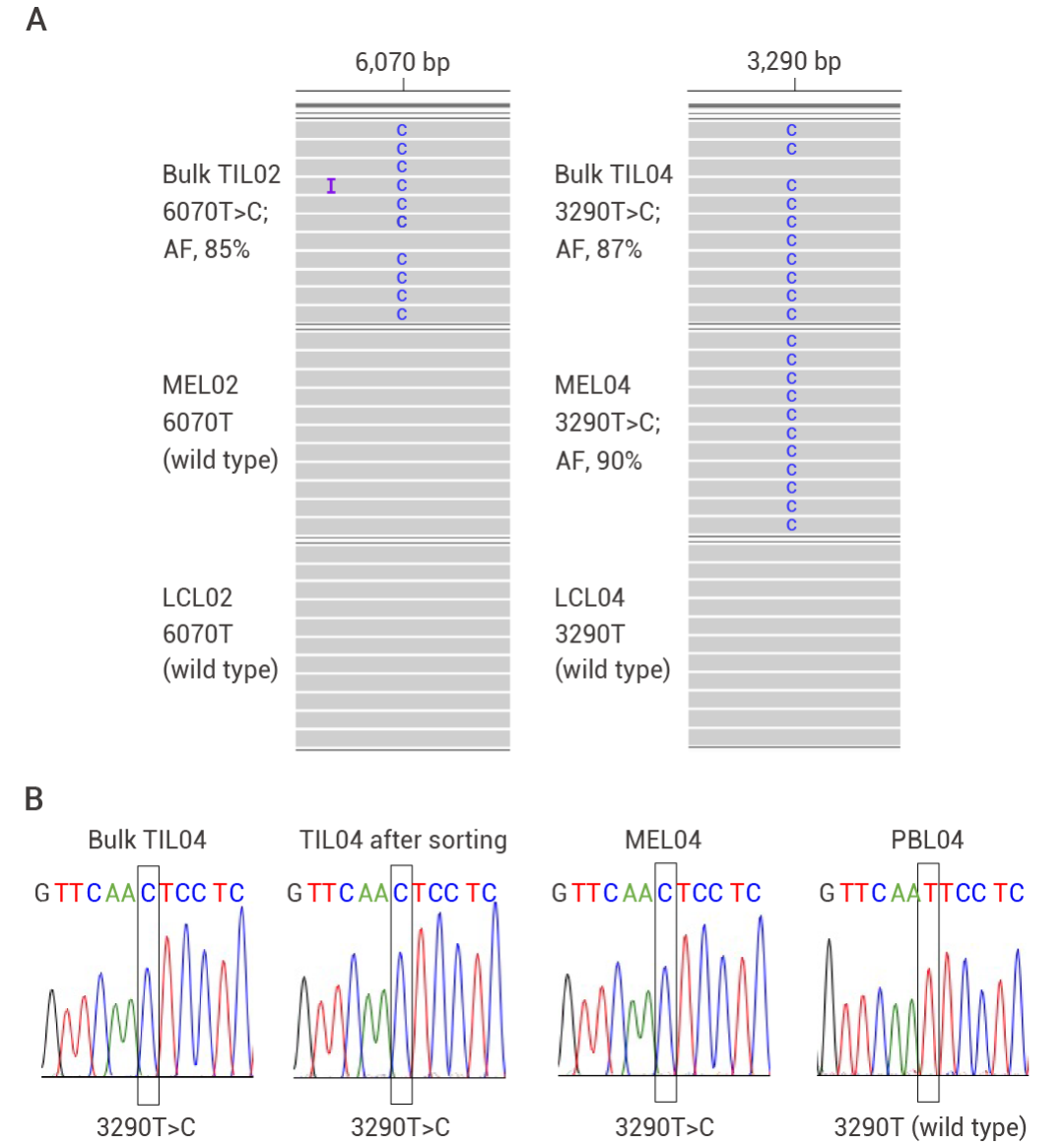
圖 3. TILs 中與癌細(xì)胞相同的突變[4]。
研究人員通過在含有突變 mtDNA 和 WT mtDNA 的黑色素瘤細(xì)胞系中的表達(dá)線粒體特異性熒光蛋白 MitoDsRed,,在與 TIL 共培養(yǎng) 24 小時后,,發(fā)現(xiàn) mtDNA 逐漸從癌細(xì)胞轉(zhuǎn)移至 TIL。這一結(jié)果表明癌細(xì)胞和 T 細(xì)胞之間產(chǎn)生同樣的 mtDNA 突變是由線粒體轉(zhuǎn)移造成的,。
已有研究證明,,細(xì)胞間的隧道納米管 和細(xì)胞外囊泡 (EVs) 能夠幫助線粒體轉(zhuǎn)移。研究人員發(fā)現(xiàn)在加入 EV 抑制劑的條件下,,均能夠大大降低線粒體的轉(zhuǎn)移,,這說明線粒體可以通過介導(dǎo)的細(xì)胞間直接接觸和 EV 介導(dǎo)的間接接觸進行轉(zhuǎn)移。綜上所述,,TILs 能夠通過直接或間接的方式從癌細(xì)胞中獲得突變 mtDNA,。
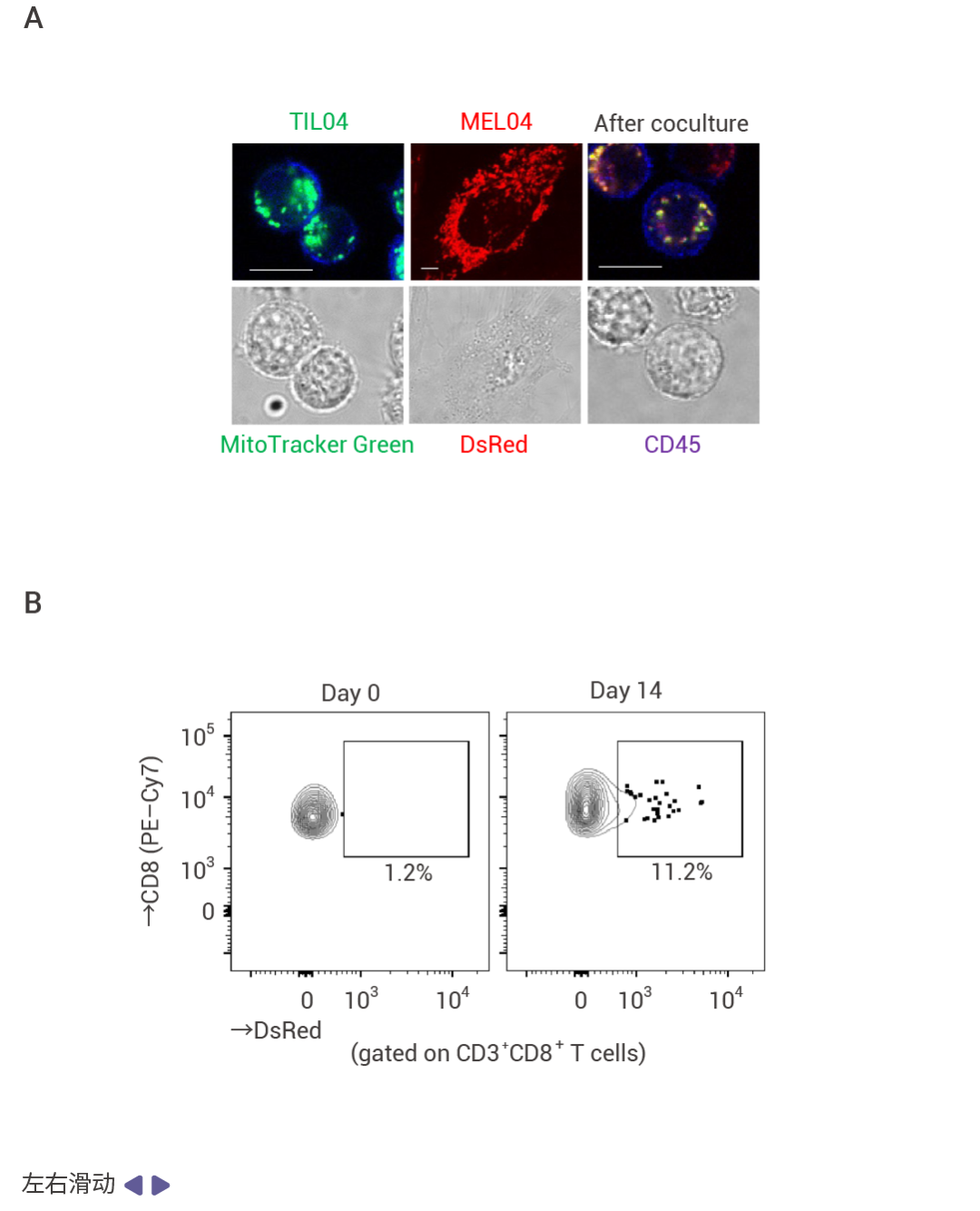
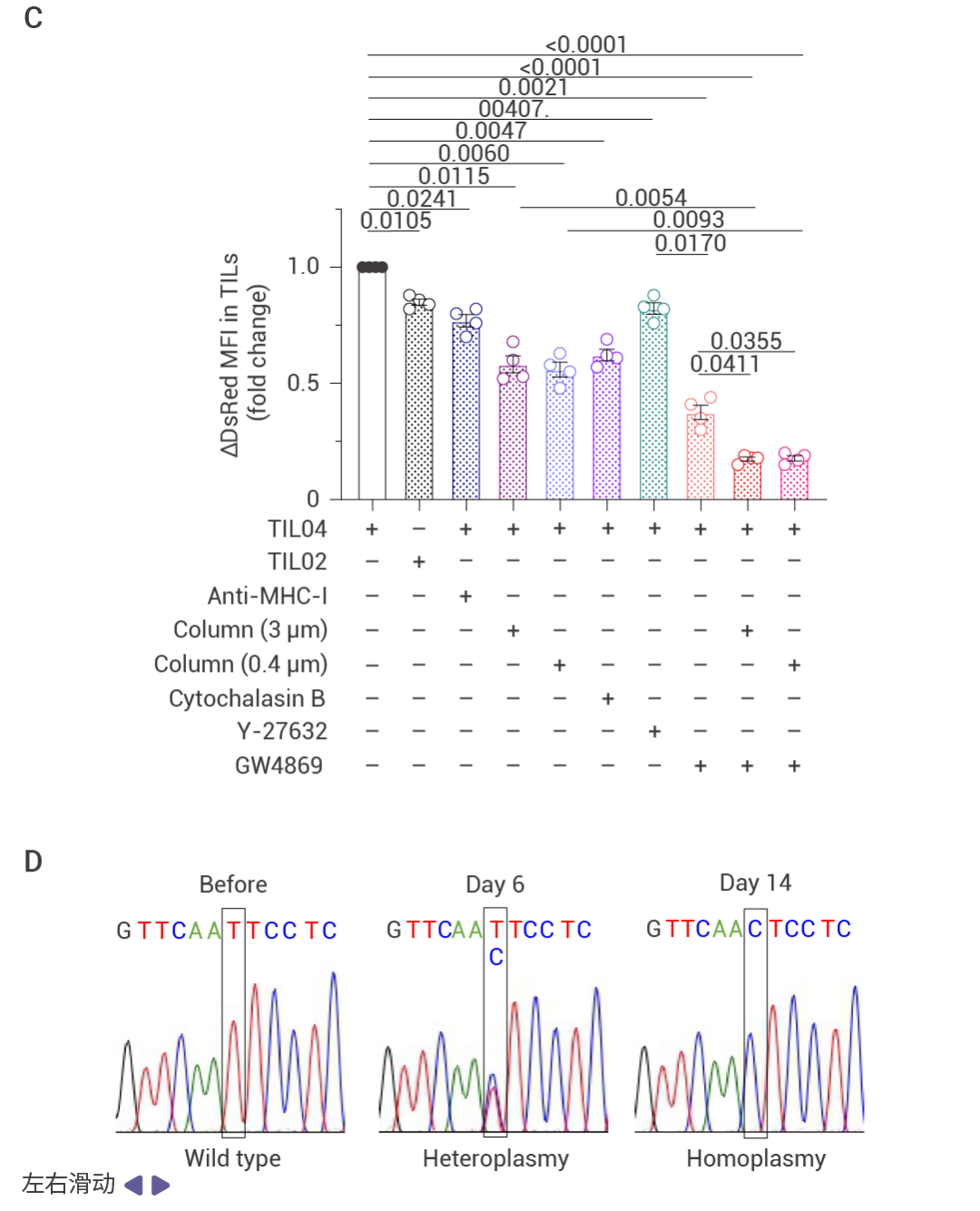
圖 4. mtDNA 突變的線粒體從癌細(xì)胞轉(zhuǎn)移到 TILs[4],。
隨后研究人員驗證了轉(zhuǎn)移的線粒體是否會發(fā)生同質(zhì)性。通過將 TIL 與癌細(xì)胞共培養(yǎng),,并通過 mtDNA 測序以及熒光標(biāo)記的延時成像,,驗證了部分 T 細(xì)胞的線粒體發(fā)生了同源替換以及線粒體的轉(zhuǎn)移。并結(jié)合 MitoDsRed 的表達(dá)情況,,進一步證明 T 細(xì)胞的原位線粒體的減少是與癌細(xì)胞共培養(yǎng)的結(jié)果,。
TME 中的癌癥來源的活性氧 (ROS) 會誘導(dǎo)周圍細(xì)胞的線粒體發(fā)生自噬。研究人員發(fā)現(xiàn),,在與癌細(xì)胞共培養(yǎng)時會加劇 T 細(xì)胞的線粒體自噬,,加入 NAC (一種 ROS 抑制劑) 后,降低 T 細(xì)胞線粒體自噬水平,,但不影響線粒體從癌細(xì)胞轉(zhuǎn)移到 T 細(xì)胞,。去泛素化酶 USP30 能夠抑制泛素化介導(dǎo)的線粒體自噬并附著在線粒體上,研究人員發(fā)現(xiàn) USP30 在黑色素瘤中高表達(dá),,且在具有突變 mtDNA 的 T 細(xì)胞中的表達(dá)量也有所增加,,USP30 染色結(jié)果證明,USP30 能夠和線粒體一同從癌細(xì)胞轉(zhuǎn)移到 TIL 中,。
以上結(jié)果表明,,T 細(xì)胞中的原位線粒體會因 TME 中的 ROS 發(fā)生自噬,但 T 細(xì)胞中有突變 mtDNA 的線粒體不會發(fā)生自噬,,最終導(dǎo)致線粒體發(fā)生同質(zhì)性,。
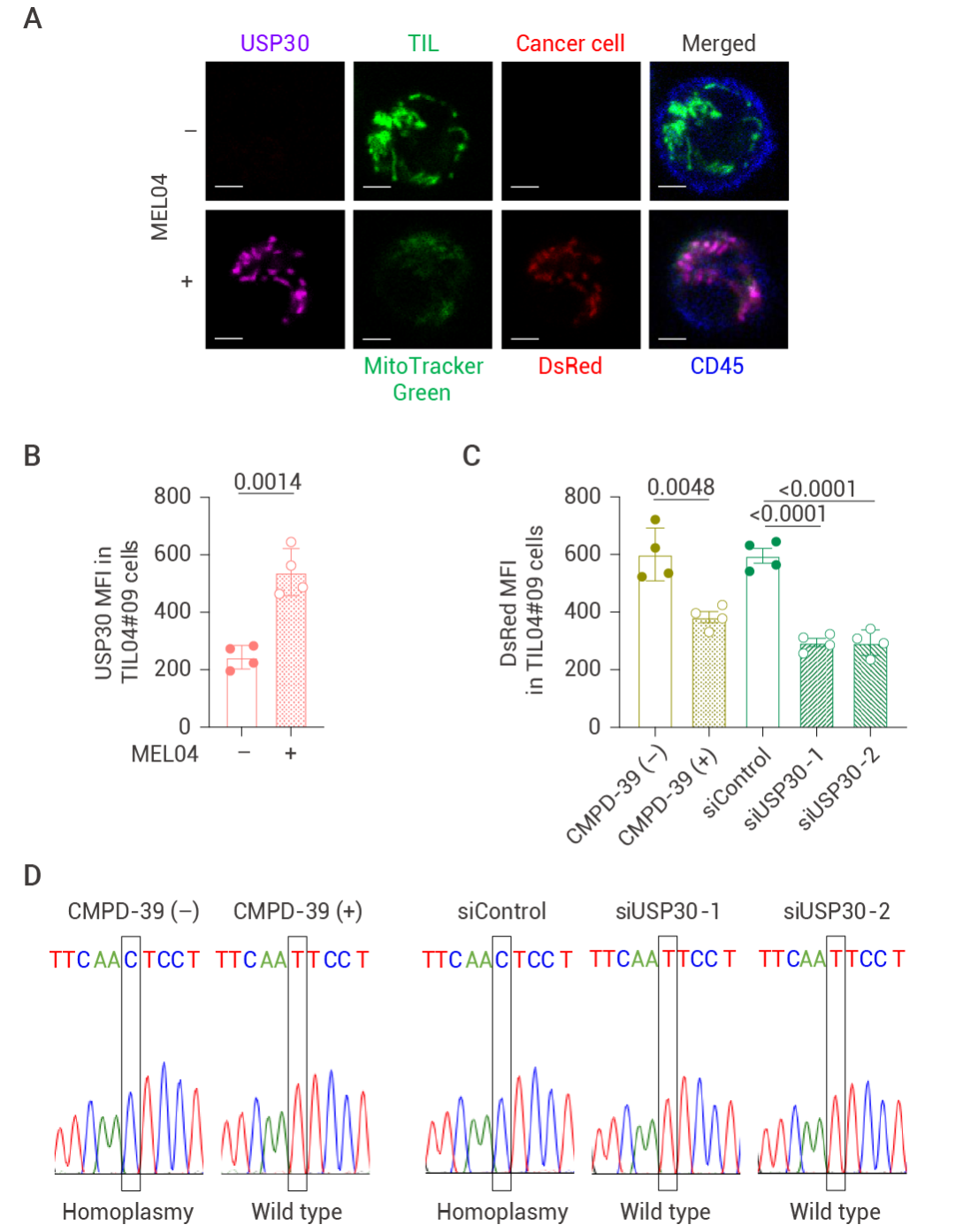
圖 5. USP30 在癌細(xì)胞轉(zhuǎn)移的線粒體中賦予線粒體自噬抗性[4]。
研究人員隨后通過通量分析儀以及基因表達(dá)水平研究發(fā)現(xiàn),,在 mtDNA 突變的細(xì)胞中線粒體氧化磷酸化相關(guān)分子 ND4,,ND5,ND6,,ND1,,CYTB,COX1 和 ATP6 的表達(dá)量降低,,細(xì)胞基礎(chǔ)呼吸減少,,產(chǎn)生的 ATP 減少,電子傳遞鏈上復(fù)合物活性降低,,以上結(jié)果表明 mtDNA 突變的細(xì)胞線粒體功能受損,。此外,突變的 mtDNA 增加了以及衰老相關(guān)分子的表達(dá),、降低細(xì)胞分裂能力,損傷記憶 T 細(xì)胞形成,、誘導(dǎo)部分中央記憶細(xì)胞的凋亡,、降低細(xì)胞中的活化標(biāo)志物的含量,。
隨后在體內(nèi)實驗中,研究人員將 mtDNA 未突變的細(xì)胞系和 mtDNA 突變的細(xì)胞系分別移植到 OT-1 小鼠體內(nèi),,由于 OT-1 小鼠可在體內(nèi)激活 T 細(xì)胞和 B 細(xì)胞反應(yīng),,隨后從小鼠體內(nèi)分選出 T 細(xì)胞以檢測其免疫功能。實驗結(jié)果表明伴有 mtDNA 突變的癌癥細(xì)胞對 T 細(xì)胞活性的降低更為顯著,。然而,,當(dāng)分選出 T 細(xì)胞進行體外培養(yǎng),熒光強弱顯示出 T 細(xì)胞損傷的功能也得到了恢復(fù),,這一結(jié)論也進一步呼應(yīng)了此前驗證的 EV 在線粒體轉(zhuǎn)移的過程中發(fā)揮關(guān)鍵作用,。此外,在外加 EV 抑制劑 GW4869 時,,相關(guān)功能抑制表型有所挽救,。
總的來說, 體內(nèi)實驗中 TIL 突變的 mtDNA 線粒體可導(dǎo)致 T 細(xì)胞功能障礙,,最終降低機體的抗腫瘤免疫能力,。
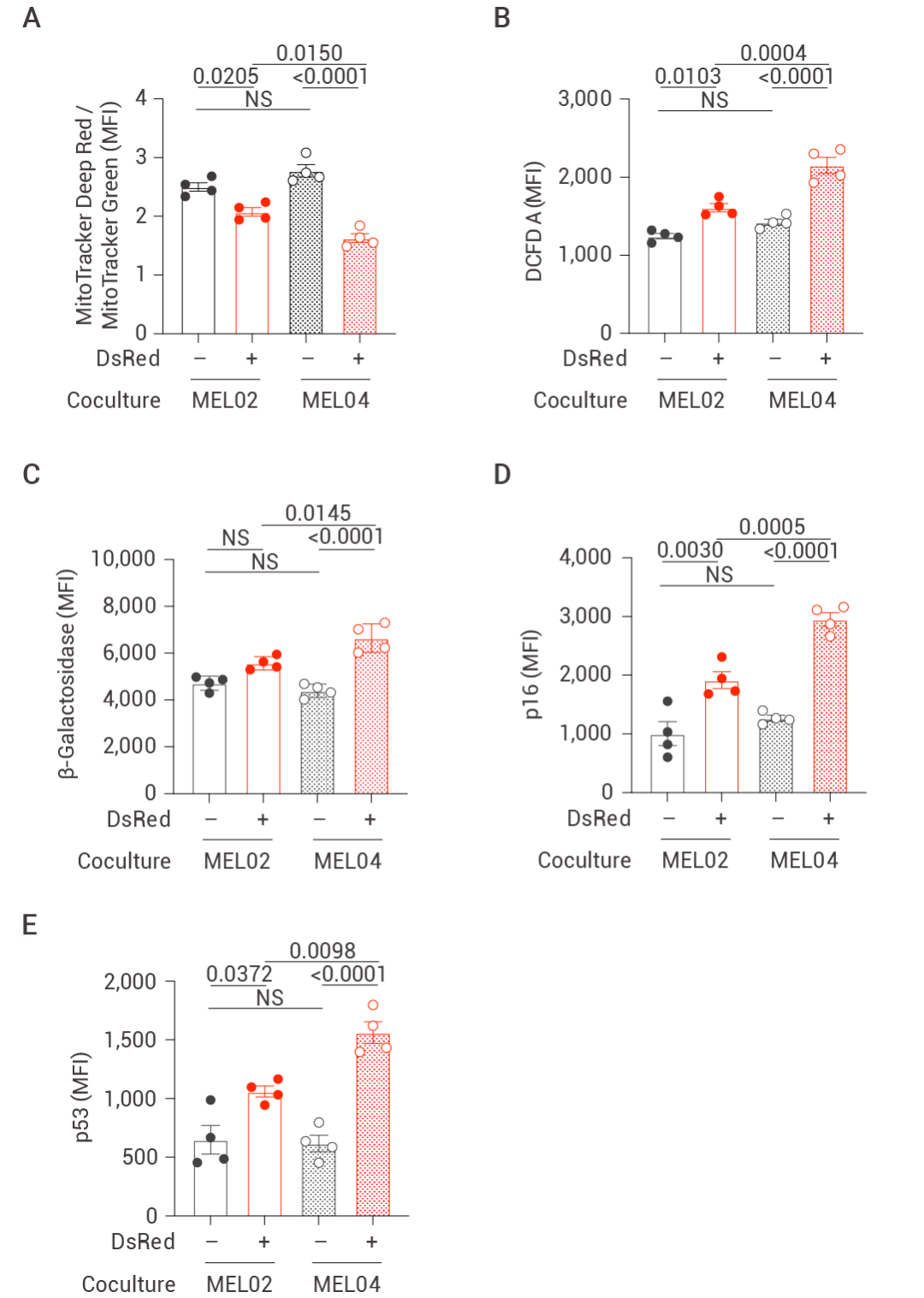
圖 6. mtDNA 突變的線粒體轉(zhuǎn)移降低體內(nèi)抗腫瘤免疫[4]。
Section.03
小結(jié)
本文解析了癌細(xì)胞如何通過線粒體轉(zhuǎn)移機制實現(xiàn)免疫逃逸,,并探討了其對腫瘤免疫治療的影響,。線粒體轉(zhuǎn)移不僅改變了 T 細(xì)胞的代謝狀態(tài),還加速了 T 細(xì)胞衰竭,,最終削弱抗腫瘤免疫力,。這一發(fā)現(xiàn)為未來癌癥免疫治療提供了新的研究方向,也希望能幫助看到這里的小伙伴拓展新的科研思路~
| 產(chǎn)品推薦 |
| JC-1 HY-15534 線粒體膜電位熒光探針 |
| MitoPBN HY-136855 線粒體抗氧化劑 |
| 線粒體靶向化合物庫 HY-L089 1,100+ 靶向線粒體代謝,、ATP 合酶,、線粒體自噬、活性氧等靶點的化合物 |
| 線粒體保護化合物庫 HY-L144 700+ 明確或潛在可以保護線粒體的化合物 |
| 線粒體毒性化合物庫 HY-L155 500+ 明確具有線粒體毒性的化合物 |
| 線粒體自噬化合物庫 HY-L180 700+ 靶向調(diào)控線粒體自噬相關(guān)靶點的化合物 |

[1] Saha T, et al. Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells. Nat Nanotechnol. 2022 Jan;17(1):98-106.
[2] Baldwin JG, et al. Intercellular nanotube-mediated mitochondrial transfer enhances T cell metabolic fitness and antitumor efficacy. Cell. 2024 Nov 14;187(23):6614-6630.e21.
[3] Mahmood M, et al. Mitochondrial DNA mutations drive aerobic glycolysis to enhance checkpoint blockade response in melanoma. Nat Cancer. 2024 Apr;5(4):659-672.
[4] Ikeda H, et al. Immune evasion through mitochondrial transfer in the tumour microenvironment. Nature. 2025 Feb;638(8049):225-236.
[5] Brestoff JR. Mitochondrial swap from cancer to immune cells thwarts anti-tumour defences. Nature. 2025 Feb;638(8049):42-43.

(空格分隔,最多3個,單個標(biāo)簽最多10個字符)
立即詢價
您提交后,專屬客服將第一時間為您服務(wù)