首頁 >> 公司動(dòng)態(tài) >> 我國科學(xué)家成功鑒定高選擇性雙泛素結(jié)合蛋白
我國科學(xué)家成功鑒定高選擇性雙泛素結(jié)合蛋白
[導(dǎo)讀] 在此基礎(chǔ)上,從哺乳動(dòng)物細(xì)胞HEK293裂解液中通過光激活雙泛素蛋白,,并應(yīng)用質(zhì)譜方法鑒定出多個(gè)能和Lys48-連接雙泛素,、Lys63-連接雙泛素結(jié)合的蛋白質(zhì),為后續(xù)進(jìn)一步分析這些雙泛素結(jié)合蛋白在細(xì)胞自噬,、DNA損傷修復(fù)等生理活動(dòng)中的功能機(jī)制提供了重要的前期基礎(chǔ),。
近日,,中國科大生命科學(xué)學(xué)院,、合肥微尺度物質(zhì)科學(xué)國家實(shí)驗(yàn)室田長麟教授和清華大學(xué)劉磊教授合作,基于蛋白質(zhì)化學(xué)全合成方法制備了不同類型的雙泛素蛋白,,在特定位點(diǎn)引入光活化交聯(lián)基團(tuán),,并成功鑒定高選擇性雙泛素結(jié)合蛋白。相關(guān)研究成果以“Chemical synthesis of diubiquitin-based photoaffinity probes for selectively profiling ubiquitin-binding proteins”為題發(fā)表在《Angewante Chemie Int. Ed.(DOI: 10.1002/anie.201611659)》上,,該文章于2017年2月1日在網(wǎng)上公開發(fā)布,。
泛素化修飾是蛋白質(zhì)翻譯后修飾中非常復(fù)雜的一類體系,目前發(fā)現(xiàn)存在8種多泛素連接方式,,分別在泛素蛋白的Met1,、Lys6、Lys11、Lys27,、Lys29,、Lys33、Lys48,、ys63等不同位點(diǎn)上接入下一個(gè)泛素蛋白,。這些不同類型的蛋白質(zhì)多泛素修飾在細(xì)胞自噬、蛋白酶體降解,、細(xì)胞信號傳導(dǎo)及DNA損傷修復(fù)等生命活動(dòng)中執(zhí)行非常多樣的功能,。但是,目前針對多泛素蛋白的生物法制備較為困難,,導(dǎo)致選擇性識別并結(jié)合多泛素修飾的蛋白質(zhì)的了解非常貧乏,。近年來,中國科大田長麟實(shí)驗(yàn)室和清華大學(xué)劉磊實(shí)驗(yàn)室通過緊密合作,,在蛋白質(zhì)化學(xué)全合成尤其是含有特種標(biāo)記,、翻譯后修飾的膜蛋白、蛋白質(zhì)復(fù)合物的化學(xué)全合成及組裝等方面取得了多項(xiàng)重要突破(Angew Chemie2013,52:9558,,JACS2014, 126:3695,,Angew Chemie2015, 54:14276, JACS2016, 128:3553等),,并于近期發(fā)展了蛋白質(zhì)泛素化修飾的化學(xué)合成技術(shù)并應(yīng)用于含泛素化修飾核小體的冷凍電鏡(cryo-EM)結(jié)構(gòu)解析(ChemBioChem2017, 18:176),。這些為基于蛋白質(zhì)化學(xué)全合成制備含有光交聯(lián)基團(tuán)的不同類型雙泛素蛋白制備和高選擇性結(jié)合蛋白的質(zhì)譜鑒定提供了重要基礎(chǔ)。
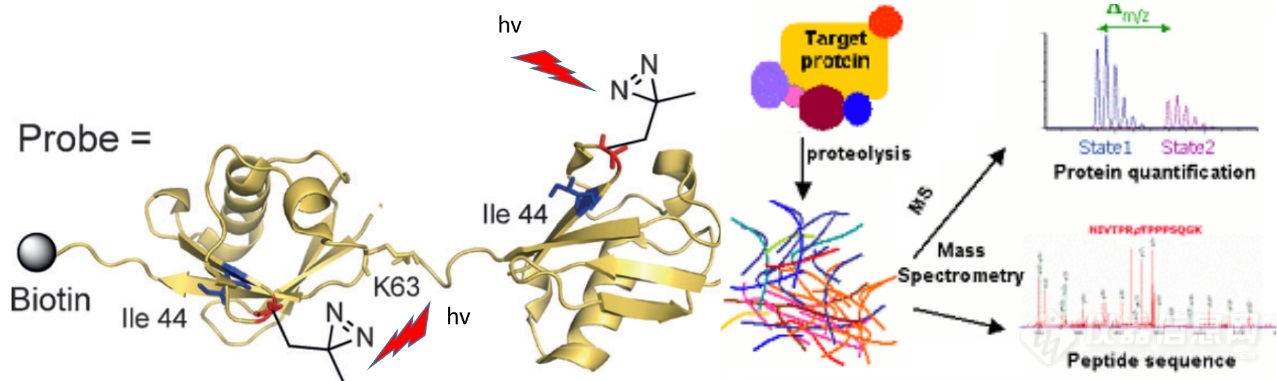
含有光交聯(lián)基團(tuán)的雙泛素蛋白化學(xué)全合成及不同類型雙泛素特異性結(jié)合蛋白的質(zhì)譜鑒定
近期,,中國科大田長麟實(shí)驗(yàn)室,、嚴(yán)以京實(shí)驗(yàn)室和清華大學(xué)劉磊實(shí)驗(yàn)室密切合作,應(yīng)用基于蛋白質(zhì)化學(xué)全合成方法制備了Lys48連接,、Lys63連接的雙泛素蛋白,,并在蛋白質(zhì)化學(xué)合成過程中在Ala46位點(diǎn)上引入不同的光交聯(lián)基團(tuán)。通過和標(biāo)準(zhǔn)泛素蛋白結(jié)合實(shí)驗(yàn),,確認(rèn)了雙泛素蛋白合成的有效性,,并優(yōu)化了光交聯(lián)基團(tuán)的反應(yīng)條件。在此基礎(chǔ)上,,從哺乳動(dòng)物細(xì)胞HEK293裂解液中通過光激活雙泛素蛋白,,并應(yīng)用質(zhì)譜方法鑒定出多個(gè)能和Lys48-連接雙泛素、Lys63-連接雙泛素結(jié)合的蛋白質(zhì),,為后續(xù)進(jìn)一步分析這些雙泛素結(jié)合蛋白在細(xì)胞自噬,、DNA損傷修復(fù)等生理活動(dòng)中的功能機(jī)制提供了重要的前期基礎(chǔ)。相關(guān)工作將為分析其他蛋白質(zhì)相互作用,、細(xì)胞中配體-受體發(fā)現(xiàn)等重要科學(xué)問題提供可靠的方法學(xué)手段,。
合肥微尺度物質(zhì)科學(xué)國家實(shí)驗(yàn)室,、化學(xué)物理系博士研究生梁軍為該研究工作的*作者。該研究工作得到了科技部,、國家自然科學(xué)基金的資助,。
[來源:中科大新聞網(wǎng)]
(空格分隔,最多3個(gè),單個(gè)標(biāo)簽最多10個(gè)字符)
立即詢價(jià)
您提交后,,專屬客服將第一時(shí)間為您服務(wù)