巴氏吸管由醫(yī)用級(jí)聚乙烯(PE)制成,,管體
結(jié)構(gòu)生物學(xué)領(lǐng)域研究進(jìn)展
本期為大家?guī)?lái)的是結(jié)構(gòu)生物學(xué)領(lǐng)域的研究進(jìn)展,,希望讀者朋友們能夠喜歡。
1.Nature & Science:冷凍電鏡技術(shù)揭示Hedgehog信號(hào)復(fù)合體的結(jié)構(gòu)
DOI: 10.1126/science.aas8843
DOI: 10.1038/s41586-018-0308-7

Hedgehog信號(hào)通路對(duì)于胚胎細(xì)胞的發(fā)育具有重要的作用,,該信號(hào)的缺失會(huì)導(dǎo)致先天性缺陷的發(fā)生,。然而,對(duì)于多數(shù)癌癥,。例如基底細(xì)胞癌,、腦癌、乳腺癌以及前列腺癌來(lái)說(shuō),,該信號(hào)的強(qiáng)度卻失去了控制,。
冷凍電鏡技術(shù)的發(fā)展幫助我們揭示了Hedgehog信號(hào)的分子機(jī)制,。通過(guò)對(duì)蛋白結(jié)構(gòu)的進(jìn)一步認(rèn)知,能夠幫助我們開(kāi)發(fā)靶向該信號(hào)的藥物分子,。
在近發(fā)表在《Science》雜志上的一篇研究中,,來(lái)自西南醫(yī)學(xué)中心以及洛克菲勒大學(xué)的研究者們解析出了原子水平的蛋白結(jié)構(gòu)。研究結(jié)果顯示,,兩個(gè)PTCH-1分子能夠同時(shí)結(jié)合一個(gè)Hedgehog(HH)分子,,但結(jié)合位點(diǎn)處于不同的部位。這一結(jié)合方式對(duì)于該信號(hào)的傳遞是十分必要的,。
冷凍電鏡的好處在于能夠?qū)悠窚囟冉抵磷銐虻?,從而不?huì)有冰晶的產(chǎn)生。這一技術(shù)對(duì)于觀察分子結(jié)構(gòu)具有很大的幫助,。
在上個(gè)月發(fā)表在《Nature》雜志上的文章中,,作者等人利用冷凍電鏡技術(shù)解析了PTCH1與HH一對(duì)一的結(jié)合結(jié)構(gòu)。生化檢測(cè)結(jié)果表明這種結(jié)合方式并不能充分地釋放其活性,。
“在近的這篇文章中,,我們發(fā)現(xiàn)PTCH1與HH二對(duì)一的結(jié)合方式。即一個(gè)HH分子通過(guò)其表面兩個(gè)不同的表位分別于兩個(gè)PTCH1進(jìn)行結(jié)合,。細(xì)胞生物學(xué)檢測(cè)結(jié)果驗(yàn)證了這種結(jié)合方式對(duì)于信號(hào)的產(chǎn)生以及傳遞的重要性,。與之前的文章結(jié)合,我們希望這些結(jié)構(gòu)有助于研究者們對(duì)該領(lǐng)域的認(rèn)知的進(jìn)一步深入”,,作者們說(shuō)道,。
2. Science:重大突破!顏寧課題組從結(jié)構(gòu)上揭示人Ptch1蛋白識(shí)別Shh機(jī)制
doi:10.1126/science.aas8935.
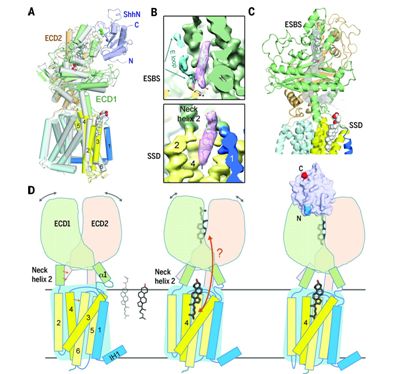
Hedgehog(Hh)通路對(duì)胚胎發(fā)生和組織再生是至關(guān)重要的,。Hh信號(hào)是通過(guò)分泌的和脂質(zhì)修飾的蛋白Hh結(jié)合到膜受體Patched(Ptch)上而被激活的,。在缺乏Hh的情況下,Ptch通過(guò)一種未知的間接機(jī)制抑制下游的G蛋白偶聯(lián)受體Smoothened(Smo),。
Hh與Ptch的結(jié)合減輕了對(duì)Smo的抑制并且開(kāi)啟讓Hh通路遭受轉(zhuǎn)錄激活的信號(hào)轉(zhuǎn)導(dǎo)事件,。Hh信號(hào)異常與出生缺陷或腫瘤發(fā)生有關(guān)。盡管進(jìn)行了嚴(yán)密的研究,,Hh,、Ptch和Smo之間相互作用的分子基礎(chǔ)仍是不清楚的,而且Ptch和Hh之間識(shí)別的結(jié)構(gòu)基礎(chǔ)還有待闡明,。
經(jīng)預(yù)測(cè)長(zhǎng)1447個(gè)氨基酸殘基的人Ptch1蛋白含有12個(gè)跨膜區(qū)段(TM),,并且與細(xì)菌RND家族轉(zhuǎn)運(yùn)蛋白(resistance-nodulation-division family transporter, RND家族轉(zhuǎn)運(yùn)蛋白)存在著結(jié)構(gòu)類似性。Ptch1的跨膜區(qū)段2(TM2)至TM6構(gòu)成固醇敏感多肽區(qū)(sterol-sensing domain, SSD),。人們已在幾種參與固醇轉(zhuǎn)運(yùn)和代謝的蛋白中發(fā)現(xiàn)了SSD,。這些含有SSD的蛋白的潛在固醇結(jié)合或轉(zhuǎn)運(yùn)活性的分子機(jī)制仍然是不清楚的。
在一項(xiàng)新的研究中,為了獲得適合于結(jié)構(gòu)研究的樣品,,來(lái)自中國(guó)清華大學(xué)的研究人員基于序列保守性和功能表征獲得幾種人Ptch1的構(gòu)建體,。終,在人胚胎腎293F細(xì)胞中瞬時(shí)表達(dá)的含有氨基酸殘基1~1305的人Ptch1截短版本在親和層析純化和尺寸排阻層析純化后表現(xiàn)出足夠的表達(dá)水平和良好的溶液行為,。他們還觀察了Ptch1的寡聚體狀態(tài)和單體狀態(tài),。Ptch1的單體形式可適用于單粒子低溫電子顯微鏡分析,這是因?yàn)樗诘蜏貤l件下具有優(yōu)異的性能,。相關(guān)研究結(jié)果發(fā)表在2018年8月10日的Science期刊上,,論文標(biāo)題為“Structural basis for the recognition of Sonic Hedgehog by human Patched1”。論文通信作者為清華大學(xué)醫(yī)學(xué)院教授顏寧(Nieng Yan)博士,。
在三種哺乳動(dòng)物Hh同源物Sonic(Shh),、Desert(Dhh)和Indian(Ihh)中,Shh一直是功能和機(jī)制研究的原型,。在大腸桿菌中表達(dá)和純化的人Shh的N-端結(jié)構(gòu)域(ShhN, 氨基酸殘基24~197)能夠在膽固醇琥珀酸單酯(cholesteryl hemisuccinate, CHS)的存在下與去污劑溶解的Ptch1蛋白形成一種穩(wěn)定的復(fù)合物,。
顏寧課題組分別在3.9埃分辨率下和在3.6埃分辨率下解析出人Ptch1單獨(dú)時(shí)以及它與ShhN結(jié)合在一起時(shí)的低溫電鏡結(jié)構(gòu)。他們識(shí)別出兩個(gè)相互作用的胞外結(jié)構(gòu)域ECD1和ECD2,,以及12個(gè)跨膜區(qū)段(TM1~12),。一旦ShhN結(jié)合,ECD1和ECD2向彼此移動(dòng),,而且它們一起構(gòu)成ShhN的??课稽c(diǎn)。顏寧課題組對(duì)ShhN與Ptch1之間的詳細(xì)識(shí)別進(jìn)行了分析和生化驗(yàn)證,。
在具有或不具有ShhN的Ptch1中觀察到兩個(gè)與CHS相一致的類固醇密度(steroid-shaped density):一個(gè)在由這兩個(gè)胞外結(jié)構(gòu)域包圍的口袋中,,另一個(gè)在SSD的膜面向的腔中?;诮Y(jié)構(gòu)的生化分析揭示出ShhN和Ptch1之間的類固醇依賴性相互作用,。相比于野生型Ptch1,類固醇結(jié)合缺陷型Ptch1突變體的結(jié)構(gòu)表現(xiàn)出顯著的構(gòu)象重排,。
總之,人Ptch1單獨(dú)時(shí)及其與ShhN結(jié)合在一起時(shí)的結(jié)構(gòu)揭示出Ptch1和ShhN之間識(shí)別的分子基礎(chǔ),。在Ptch1中鑒定出兩個(gè)類固醇結(jié)合位點(diǎn)為在未來(lái)研究Hh信號(hào)建立了重要的框架,,并對(duì)含有SSD蛋白的固醇感知提供了關(guān)鍵見(jiàn)解。
3. Cell:重磅,!破解人cGAS的三維結(jié)構(gòu),,揭示它為何識(shí)別長(zhǎng)片段DNA同時(shí)忽略短片段DNA
doi:10.1016/j.cell.2018.06.026

人體是為生存而建造的。人體中的每一個(gè)細(xì)胞都受到一組免疫蛋白的嚴(yán)密保護(hù),,而且這些免疫蛋白裝備了幾乎*的雷達(dá)來(lái)檢測(cè)外來(lái)的或受損的DNA,。
人細(xì)胞中的一個(gè)為關(guān)鍵的哨兵是一種被稱作cGAS的“響應(yīng)者”蛋白,它檢測(cè)外來(lái)的和發(fā)生癌變的DNA的存在,,并啟動(dòng)一種信號(hào)級(jí)聯(lián)反應(yīng),,從而觸發(fā)身體防御,。
2012年蛋白cGAS的發(fā)現(xiàn)引發(fā)了科學(xué)探究的風(fēng)暴,迄今為止,,科學(xué)家們已針對(duì)它發(fā)表了500多份研究出版物,,但是人cGAS蛋白的結(jié)構(gòu)和關(guān)鍵特征仍然困擾著科學(xué)家。
如今,,在一項(xiàng)新的研究中,,來(lái)自美國(guó)哈佛醫(yī)學(xué)院和達(dá)納-法伯癌癥研究所的研究人員鑒定出人cGAS蛋白與其他哺乳動(dòng)物中的GAS蛋白之間的結(jié)構(gòu)差異和功能差異,并揭示出它在人體中發(fā)揮*功能的結(jié)構(gòu)基礎(chǔ),。這項(xiàng)研究概述了人cGAS蛋白的結(jié)構(gòu)特征,,這些結(jié)構(gòu)特征解釋了人cGAS為何和如何識(shí)別某些類型的DNA同時(shí)忽略其他類型的DNA。相關(guān)研究結(jié)果發(fā)表在2018年7月12日的Cell期刊上,,論文標(biāo)題為“Structure of the Human cGAS–DNA Complex Reveals Enhanced Control of Immune Surveillance”,。
論文通信作者、哈佛醫(yī)學(xué)院/達(dá)納-法伯癌癥研究所微生物學(xué)與免疫生物學(xué)助理教授Philip Kranzusch說(shuō),,“人cGAS的結(jié)構(gòu)和作用機(jī)制一直是免疫學(xué)和癌癥生物學(xué)領(lǐng)域中的一個(gè)關(guān)鍵的缺失部分,。我們的研究結(jié)果詳細(xì)闡述了人cGAS的分子組成和功能,從而彌補(bǔ)了我們的知識(shí)中的這個(gè)重要的缺口,。”
重要的是,,這些研究結(jié)果能夠?yàn)樵O(shè)計(jì)適合人cGAS蛋白的*結(jié)構(gòu)特征的小分子藥物提供了信息---這一進(jìn)展有望改進(jìn)當(dāng)前作為抗癌療法正在開(kāi)發(fā)中的cGAS調(diào)節(jié)藥物。
Kranzusch說(shuō),,“當(dāng)前正在開(kāi)發(fā)中的幾種有前途的實(shí)驗(yàn)性免疫療法是針對(duì)小鼠cGAS的結(jié)構(gòu)而被開(kāi)發(fā)出的,,它與人cGAS存在著關(guān)鍵的結(jié)構(gòu)差異。我們的發(fā)現(xiàn)應(yīng)該有助于優(yōu)化這些實(shí)驗(yàn)性療法并促進(jìn)人們?cè)O(shè)計(jì)出新的療法,。這將為結(jié)構(gòu)導(dǎo)向地設(shè)計(jì)調(diào)節(jié)這個(gè)基礎(chǔ)蛋白活性的藥物鋪平道路,。”
Kranzusch團(tuán)隊(duì)的研究結(jié)果解釋了人cGAS蛋白的一個(gè)*特征---相比于其他動(dòng)物中的cGAS蛋白,它能夠高度選擇性地檢測(cè)某些類型的DNA而且它更不容易被激活,。
具體而言,,這項(xiàng)研究表明人cGAS攜帶的突變使得它對(duì)長(zhǎng)片段DNA非常敏感,但是也讓它對(duì)短片段DNA“不敏感”,。
論文共同作者,、哈佛醫(yī)學(xué)院微生物學(xué)與免疫生物學(xué)系博士后研究員Aaron Whiteley說(shuō),“人cGAS是一種高度選擇性的蛋白,,它已進(jìn)化出更強(qiáng)的DNA特異性,。我們的實(shí)驗(yàn)揭示出這種能力的基礎(chǔ)。”
在所有哺乳動(dòng)物中,,cGAS都是通過(guò)檢測(cè)處于錯(cuò)誤位置的DNA來(lái)發(fā)揮作用的,。在正常條件下,DNA被緊密地包裝在細(xì)胞核中并受到保護(hù)。DNA沒(méi)有理由會(huì)在細(xì)胞周圍自由移動(dòng),。當(dāng)DNA片段確實(shí)終逃離細(xì)胞核并進(jìn)入細(xì)胞質(zhì)中時(shí),,這通常表明存在著一些不祥之兆,比如來(lái)自細(xì)胞內(nèi)的損傷或來(lái)自侵入細(xì)胞內(nèi)的病毒或細(xì)菌的外來(lái)DNA,。
cGAS蛋白通過(guò)識(shí)別這種處于錯(cuò)誤位置的DNA而發(fā)揮作用,。在正常情形下,它在細(xì)胞中處于休眠狀態(tài),。但是一旦cGAS檢測(cè)到DNA存在于細(xì)胞核外面,,它就突然起作用。它產(chǎn)生另一種化學(xué)物質(zhì)---一種被稱作cGAMP的第二種信使,,從而引發(fā)一種分子鏈反應(yīng),,結(jié)果就是提醒細(xì)胞中的DNA異常存在。在這種信號(hào)級(jí)聯(lián)反應(yīng)結(jié)束時(shí),,細(xì)胞要么得到修復(fù),,要么因損壞到無(wú)法修復(fù)的地步,它就會(huì)自我破壞,。
但是細(xì)胞的健康和完整性取決于cGAS能夠?qū)o(wú)害的DNA和外來(lái)DNA或在細(xì)胞遭受損傷和應(yīng)激期間釋放出的自身DNA區(qū)分開(kāi)來(lái),。
論文共同作者、哈佛醫(yī)學(xué)院/達(dá)納-法伯癌癥研究所博士后研究員Wen Zhou說(shuō),,“這是一種很好的平衡行為,,可確保免疫系統(tǒng)保持平衡。過(guò)度活躍的cGAS能夠引發(fā)自身免疫反應(yīng)或自我攻擊,,而未能檢測(cè)到外來(lái)DNA的cGAS能夠?qū)е履[瘤生長(zhǎng)和癌癥進(jìn)展,。”
這項(xiàng)新的研究揭示出這種蛋白結(jié)構(gòu)的進(jìn)化變化,從而允許人cGAS忽略它遇到的一些DNA,,同時(shí)對(duì)它遇到的其他DNA作出反應(yīng),。
就這項(xiàng)新的研究而言,這些研究人員的研究對(duì)象是霍亂弧菌(Vibrio cholerae),。這種細(xì)菌會(huì)導(dǎo)致霍亂,,也是人類古老的禍害之一。
利用一種與cGAS具有相似性的霍亂弧菌酶,,這些研究人員能夠在這種細(xì)菌中重建人和小鼠cGAS蛋白的功能,。
通過(guò)與來(lái)自哈佛醫(yī)學(xué)院細(xì)菌學(xué)家John Mekalanos實(shí)驗(yàn)室的同事們合作,這些研究人員設(shè)計(jì)出一種嵌合或雜合形式的cGAS,,它包括來(lái)自人類和小鼠cGAS的遺傳物質(zhì)。隨后,,他們將這種雜合cGAS識(shí)別DNA的能力與完整的人cGAS和小鼠cGAS的識(shí)別能力進(jìn)行比較,。
在一系列實(shí)驗(yàn)中,這些研究人員觀察了這些不同類型cGAS之間的激活模式,并逐步縮小導(dǎo)致這三者之間存在不同DNA激活模式的關(guān)鍵差異,。
這些實(shí)驗(yàn)表明在人類和小鼠cGAS中存在差異的116個(gè)氨基酸中,,僅兩個(gè)氨基酸導(dǎo)致人cGAS的功能變化。確實(shí),,人cGAS能夠高精度地識(shí)別長(zhǎng)片段DNA,,但它會(huì)忽略了短片段DNA。相反,,小鼠cGAS不能區(qū)分長(zhǎng)片段DNA和短片段DNA,。
Whiteley說(shuō),“這兩個(gè)微小的氨基酸發(fā)揮著如此重大的作用,。它們讓人cGAS具有高度選擇性,,僅對(duì)長(zhǎng)片段DNA作出反應(yīng),同時(shí)忽略短片段DNA,,這就使得人cGAS更能耐受DNA在細(xì)胞質(zhì)中的存在,。”
通過(guò)在進(jìn)化時(shí)間尺度上繪制遺傳分歧,這些研究人員確定人類和小鼠cGAS基因在1000萬(wàn)到1500萬(wàn)年前的某個(gè)時(shí)間分開(kāi),。
負(fù)責(zé)檢測(cè)長(zhǎng)片段DNA和耐受短片段DNA的這兩個(gè)氨基酸僅在人類和非人靈長(zhǎng)類動(dòng)物(比如大猩猩,,黑猩猩和倭黑猩猩)中發(fā)現(xiàn)到。
這些研究人員猜測(cè)忽略短片段DNA但識(shí)別長(zhǎng)片段DNA的能力必定會(huì)帶來(lái)一些進(jìn)化上的好處,。
Kranzusch說(shuō),,“這可能是一種阻止過(guò)度活躍的免疫系統(tǒng)和慢性炎癥的方法?;蛘哌@可能是通過(guò)不識(shí)別短片段DNA來(lái)降低患上某些人類疾病的風(fēng)險(xiǎn),。”
在后一組實(shí)驗(yàn)中,這些研究人員解析出人cGAS的活性形式與DNA結(jié)合在一起時(shí)的原子結(jié)構(gòu),。
為了做到這一點(diǎn),,他們使用了一種被稱作X射線晶體衍射的可視化技術(shù)。這種技術(shù)能夠基于X射線衍射圖案揭示出蛋白晶體的分子結(jié)構(gòu),。
分析人cGAS“在發(fā)揮作用時(shí)”的結(jié)構(gòu)揭示出讓它能夠選擇性地結(jié)合長(zhǎng)片段DNA同時(shí)忽略短片段DNA的分子變異,。
Kranzusch說(shuō),“理解是什么讓人cGAS的結(jié)構(gòu)和功能與其他物種cGAS存在的差異正是這個(gè)缺失的部分,。如今,,我們解析出它的結(jié)構(gòu),我們真地能夠開(kāi)始設(shè)計(jì)適用于人體而不適用于小鼠的藥物,。”
4.多篇Nature論文解析出結(jié)合到DNA上的起點(diǎn)復(fù)制復(fù)合物的高清晰結(jié)構(gòu)
doi:10.1038/nature14685.
doi:10.1038/nsmb.3374.
doi:10.1038/s41586-018-0293-x.
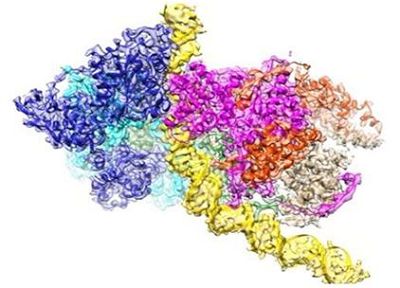
細(xì)胞通過(guò)基因組復(fù)制產(chǎn)生自身的拷貝而進(jìn)行增殖,。按理說(shuō),DNA復(fù)制是所有生命形式中基本和保守的機(jī)制,。破解這一過(guò)程是如何地實(shí)現(xiàn)的秘密是理解生命秘密的關(guān)鍵,。當(dāng)沃森和克里克在半個(gè)多世紀(jì)前基于DNA雙螺旋結(jié)構(gòu)提出DNA的復(fù)制方式時(shí),,許多人認(rèn)為將兩條DNA鏈分開(kāi)進(jìn)行復(fù)制的分子機(jī)器(即DNA復(fù)制機(jī)器,或者說(shuō)DNA復(fù)制復(fù)合物)的結(jié)構(gòu)即將出現(xiàn),。然而,,鑒于這種分子機(jī)器具有比較大的尺寸、三重特性(它由三個(gè)引擎組成)和靈活性,,它遠(yuǎn)要比之前想象的復(fù)雜得多,。利用常規(guī)方法無(wú)法獲得這種DNA復(fù)制機(jī)器在原子分辨率下的結(jié)構(gòu)信息。近年來(lái),,隨著高分辨率的低溫電鏡(cryo-EM)技術(shù)的來(lái)臨,,人們才能獲得它在原子分辨率下的結(jié)構(gòu)信息。
中國(guó)北京大學(xué)的高寧(Ning Gao)團(tuán)隊(duì)和中國(guó)香港科技大學(xué)的Bik-Kwoon Tye團(tuán)隊(duì)合作發(fā)表的一系列論文為以的分辨率破解DNA復(fù)制機(jī)器的功能打開(kāi)了大門(mén),。篇論文于2015年發(fā)表在Nature期刊上,,它解析出這種被稱作微小染色體維持蛋白復(fù)合物(minichromosome maintenance complex, MCM蛋白復(fù)合物)的DNA復(fù)制機(jī)器的核心引擎的結(jié)構(gòu)。第二篇論文報(bào)道了Cdt1-Mcm2-7復(fù)合物(作為MCM雙六聚體復(fù)合物的前體)的開(kāi)環(huán)結(jié)構(gòu),。如今,,第三篇論文發(fā)表在Nature期刊上,它詳細(xì)地說(shuō)明了起始識(shí)別復(fù)合物(Origin Recognition Complex, ORC)的原子結(jié)構(gòu),,其中ORC復(fù)合物選擇全基因組中的復(fù)制起始位點(diǎn)以便啟動(dòng)DNA復(fù)制,。
在單個(gè)細(xì)胞(受精卵)經(jīng)過(guò)大約1016次細(xì)胞分裂后,每個(gè)人就產(chǎn)生了,。每次細(xì)胞分裂都需要基因組的復(fù)制,,這樣每個(gè)子細(xì)胞都以DNA的形式獲得*相同的遺傳信息。
導(dǎo)致細(xì)胞分裂失調(diào)的異常DNA復(fù)制是許多癌癥和發(fā)育障礙的原因,?;蚪M復(fù)制在維持活的有機(jī)體方面同樣起著重要的作用,這是因?yàn)樗屑?xì)胞都具有“有效期限”,,并且大多數(shù)細(xì)胞都由保留分裂能力的干細(xì)胞進(jìn)行補(bǔ)充,。
衰老也是這種復(fù)制機(jī)器發(fā)生故障(無(wú)論是發(fā)生在受損DNA的修復(fù)合成中,還是發(fā)生在全基因組復(fù)制的保真度中)的一般現(xiàn)象,。在第三篇論文中,,中國(guó)北京大學(xué)的高寧教授和中國(guó)香港科技大學(xué)的Bik-Kwoon Tye教授和Yuanliang Zhai博士利用低溫電鏡技術(shù)在原子分辨率下解析出啟動(dòng)DNA復(fù)制的ORC復(fù)合物的結(jié)構(gòu)。這種結(jié)構(gòu)解釋了ORC復(fù)合物如何能夠掃描大量的堿基(DNA由A,、T,、G和C四種堿基組成),從中選擇出正確的位點(diǎn)開(kāi)始進(jìn)行DNA復(fù)制,。據(jù)信,,不加區(qū)分地選擇太多的位點(diǎn)可能導(dǎo)致基因組的快速?gòu)?fù)制并因此導(dǎo)致快速的細(xì)胞分裂,這是癌細(xì)胞的特征,。相比之下,,低效地選擇位點(diǎn)會(huì)導(dǎo)致細(xì)胞分裂緩慢,,特別是在人類發(fā)育的關(guān)鍵時(shí)刻,這可能導(dǎo)致發(fā)育障礙,。
一個(gè)典型的病例是Meier-Gorlin綜合征(MGS),這是一種罕見(jiàn)的遺傳性侏儒癥,,其特征是產(chǎn)前發(fā)育遲緩和產(chǎn)后比例矮小的身材,。有趣的是,與Meier-Gorlin綜合征相關(guān)的突變位于5個(gè)基因(ORC1,、ORC4,、ORC6、CDT1和CDC6)中,,所有的這些基因都是這種DNA復(fù)制起始機(jī)器(即ORC復(fù)合物)的組分,。ORC1和ORC4發(fā)生突變的患者似乎具有嚴(yán)重的身材矮小。在第三篇論文中,,高寧教授和Bik-Kwoon Tye教授等證實(shí)在形成這種DNA復(fù)制起始機(jī)器的六個(gè)亞基中,,ORC1和ORC4在復(fù)制起始位點(diǎn)的選擇機(jī)制中起著決定性作用。
從根本上說(shuō),,ORC復(fù)合物的重要功能是招募MCM雙六聚體復(fù)合物到DNA復(fù)制起點(diǎn)上,,其中MCM雙六聚體復(fù)合物是將雙鏈DNA分離開(kāi)的DNA解旋酶的催化核心。在第三篇論文中報(bào)道的ORC復(fù)合物結(jié)合到DNA上時(shí)的原子結(jié)構(gòu)揭示出ORC復(fù)合物導(dǎo)致的DNA彎曲為DNA插入到MCM解旋酶的開(kāi)環(huán)結(jié)構(gòu)中提供一個(gè)停泊表面,。再者,,它揭示出DNA復(fù)制起點(diǎn)是基于它的*結(jié)構(gòu)而不是基于它的特定堿基序列而被選擇出來(lái)的。這些新發(fā)現(xiàn)有助于解釋ORC復(fù)合物如何在基因組中的*位點(diǎn)上選擇復(fù)制起點(diǎn),,而且這些位點(diǎn)僅由它們的堿基序列是無(wú)法預(yù)測(cè)到的,。
DNA復(fù)制是所有有機(jī)體的一個(gè)決定性特征,而且執(zhí)行這一功能的DNA復(fù)制機(jī)器從真菌到植物到人類都是保守的,。理解這種DNA復(fù)制機(jī)器(或任何生物分子機(jī)器)的原子結(jié)構(gòu)是至關(guān)重要的,,這是因?yàn)樗械膽?yīng)用技術(shù)和工程技術(shù)都建立在基礎(chǔ)科學(xué)/知識(shí)的基礎(chǔ)之上。比如,, DNA復(fù)制機(jī)器在3埃分辨率下的三維結(jié)構(gòu)圖可能有助我們鑒定出更好的癌癥治療靶標(biāo),,這樣就可定制產(chǎn)生適合這種靶標(biāo)的合成化學(xué)物。更重要的是,,這些結(jié)構(gòu)有助于我們充分理解分子機(jī)器的作用機(jī)制,,從而有助我們理解因這些分子機(jī)器未發(fā)揮jia功能而導(dǎo)致的疾病的根源。為實(shí)現(xiàn)這一目標(biāo),,中國(guó)香港科技大學(xué)將建立先進(jìn)的低溫電子顯微設(shè)備,,用于研究生物分子機(jī)器的高分辨率結(jié)構(gòu)。
5. Nature:重大進(jìn)展,!解析出人突觸GABAA受體的三維結(jié)構(gòu),,有望開(kāi)發(fā)出治療癲癇等神經(jīng)疾病的新型藥物
doi:10.1038/s41586-018-0255-3
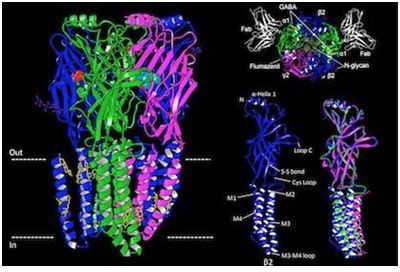
許多藥物---不論是合法的還是非法的---都作用于大腦中為豐富和為重要的神經(jīng)遞質(zhì)受體之一:A型GABA受體(type A GABA receptor, GABAA受體),。特別的是苯二氮平類藥物(benzodiazepine),它們用于外科手術(shù)期間的麻醉,,并用于治療癲癇,、焦慮和失眠。解析出這種受體的三維結(jié)構(gòu)有朝一日可能導(dǎo)致人們開(kāi)發(fā)出更好地治療這些疾病的方法,。
GABAA受體與γ-氨基丁酸(GABA)結(jié)合,,其中GABA是成年大腦中主要的抑制性或鎮(zhèn)靜性神經(jīng)遞質(zhì)。為了正常地發(fā)揮作用,,大腦需要平衡刺激性信號(hào)和鎮(zhèn)靜性信號(hào),。GABAA受體功能障礙在以大腦中過(guò)度興奮為特征的疾病(如癲癇)中發(fā)現(xiàn)到,。除了鎮(zhèn)靜劑苯二氮平類藥物之外,,GABAA受體是巴比妥類藥物、麻醉藥和酒精的常見(jiàn)靶標(biāo),。所有的這些藥物都通過(guò)增加GABAA受體的活性而作用于大腦,,從而進(jìn)一步抑制大腦活動(dòng)。
*,,GABAA受體的三維結(jié)構(gòu)很難利用X射線衍射晶體分析法解析出,。長(zhǎng)期以來(lái),這種方法被認(rèn)為是結(jié)構(gòu)生物學(xué)的黃金標(biāo)準(zhǔn),。它需要蛋白結(jié)晶,,這樣就能夠根據(jù)X射線衍射圖譜來(lái)確定蛋白結(jié)構(gòu)。
在一項(xiàng)新的研究中,,來(lái)自美國(guó)德克薩斯大學(xué)西南醫(yī)學(xué)中心的研究人員尋求低溫電鏡技術(shù)(cryo-EM)的幫助,。他們利用cryo-EM技術(shù)成功地解析出GABAA受體結(jié)合到GABA和藥物氟馬西尼(flumazenil)上的三維結(jié)構(gòu)。相關(guān)研究結(jié)果于2018年6月27日在線發(fā)表在Nature期刊上,,論文標(biāo)題為“Structure of a human synaptic GABAA receptor”,。論文通信作者為德克薩斯大學(xué)西南醫(yī)學(xué)中心神經(jīng)科學(xué)與生物物理學(xué)助理教授Ryan Hibbs博士。論文作者為Hibbs實(shí)驗(yàn)室博士后研究員Shaotong Zhu博士,。
這些研究人員在燒瓶中利用細(xì)胞表達(dá)人突觸GABAA受體并加以純化,,并將電生理學(xué)實(shí)驗(yàn)和利用cryo-EM技術(shù)獲得的結(jié)構(gòu)信息結(jié)合在一起來(lái)測(cè)試di西泮(一種苯二氮卓類藥物)和氟馬西尼對(duì)這種GABAA受體的影響,其中氟馬西尼用于逆轉(zhuǎn)麻醉和治療苯二氮平類藥物過(guò)量 Hibbs博士說(shuō),,“我們能夠確定GABA如何選擇性地與這種受體結(jié)合,,并解釋諸如苯二氮卓類藥物和氟馬西尼---它競(jìng)爭(zhēng)性地作用于相同的位點(diǎn)上來(lái)逆轉(zhuǎn)苯二氮卓類藥物的效果---之類的藥物為何特異性地作用于這種受體上。這對(duì)于理解藥物結(jié)合機(jī)制和設(shè)計(jì)治療多種神經(jīng)疾病的新藥產(chǎn)生深遠(yuǎn)的影響,。”
6. Nature:重大突破,!從結(jié)構(gòu)上揭示間日瘧原蟲(chóng)入侵人紅細(xì)胞機(jī)制
doi:10.1038/s41586-018-0249-1
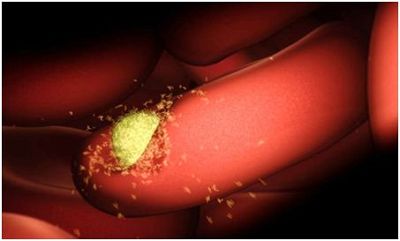
瘧原蟲(chóng)入侵人體的年輕紅細(xì)胞,隨后開(kāi)始在整個(gè)身體中擴(kuò)散,。在一項(xiàng)新的研究中,,來(lái)自澳大利亞和美國(guó)的研究人員利用低溫電鏡技術(shù)(cryo-EM)在原子水平上揭示出間日瘧原蟲(chóng)(Plasmodium vivax)如何入侵人體紅細(xì)胞的三維藍(lán)圖,。他們繪制出這種瘧原蟲(chóng)與它們?nèi)肭值哪贻p紅細(xì)胞之間的接觸,從而破解了它們用來(lái)附著到人紅細(xì)胞上的分子機(jī)器---間日瘧原蟲(chóng)蛋白PvRBP2b與人轉(zhuǎn)鐵蛋白受體1(TfR1)和轉(zhuǎn)鐵蛋白結(jié)合在一起而形成的一種三元入侵復(fù)合物---的三維結(jié)構(gòu),。這為開(kāi)發(fā)新型瘧疾疫苗邁出了重要的一步,。相關(guān)研究結(jié)果于2018年6月27日在線發(fā)表在Nature期刊上,論文標(biāo)題為“Cryo-EM structure of an essential Plasmodium vivax invasion complex”,。論文通信作者為美國(guó)霍華德休斯醫(yī)學(xué)研究所研究員Zhiheng Yu博士和澳大利亞沃爾特-伊麗莎-霍爾醫(yī)學(xué)研究所的Wai-Hong Tham博士,。論文作者為沃爾特-伊麗莎-霍爾醫(yī)學(xué)研究所的Jakub Gruszczyk博士和霍華德休斯醫(yī)學(xué)研究所的Rick Huang博士。
今年初,,在一項(xiàng)發(fā)表在Science期刊上的研究中,這些研究人員已發(fā)現(xiàn)間日瘧原蟲(chóng)通過(guò)劫持人轉(zhuǎn)鐵蛋白受體入侵人體紅細(xì)胞(Science, doi:10.1126/science.aan1078,,詳情參見(jiàn)生物谷新聞報(bào)道:重磅,!開(kāi)發(fā)瘧疾疫苗有戲!揭示間日瘧原蟲(chóng)通過(guò)劫持人轉(zhuǎn)鐵蛋白受體入侵紅細(xì)胞),。如今,,在革命性的cryo-EM技術(shù)的幫助下,他們能夠在原子水平下可視化觀察PvRBP2b與TfR1和轉(zhuǎn)鐵蛋白之間的相互作用,。這就為開(kāi)發(fā)潛在的抗瘧疾藥物和疫苗奠定基礎(chǔ),。
間日瘧原蟲(chóng)是世界上分布為廣泛的瘧原蟲(chóng),也是非洲以外絕大多數(shù)國(guó)家中的瘧疾病例的主要原因,。鑒于它隱藏在人體肝臟中而不被免疫系統(tǒng)檢測(cè)到,,它也是導(dǎo)致復(fù)發(fā)性瘧疾感染的*瘧原蟲(chóng)。
在這種三維結(jié)構(gòu)的指導(dǎo)下,,這些研究人員能夠解析出這種瘧原蟲(chóng)-宿主相互作用的確切細(xì)節(jié),,并鑒定出它的為脆弱的位點(diǎn)。
Tham說(shuō),,“這基本上是一項(xiàng)設(shè)計(jì)挑戰(zhàn),。間日瘧原蟲(chóng)是非常多樣化的,這對(duì)疫苗開(kāi)發(fā)具有挑戰(zhàn)性,。我們?nèi)缃耔b定出這種分子機(jī)器,,它將是開(kāi)發(fā)出有效地抵抗一系列間日瘧原蟲(chóng)的抗瘧劑疫苗的hao靶標(biāo)。”
她說(shuō),,“憑借這種的細(xì)節(jié),,我們?nèi)缃衲軌蜷_(kāi)始設(shè)計(jì)專門(mén)靶向和破壞這種瘧原蟲(chóng)的三元入侵復(fù)合物的新型療法,以便阻止它們劫持人紅細(xì)胞并通過(guò)血液在體內(nèi)擴(kuò)散,,從而終阻止它們傳播給其他人,。”
7. Science:從結(jié)構(gòu)上揭示tau蛋白與微管之間的相互作用,有助深入認(rèn)識(shí)神經(jīng)疾病
doi:10.1126/science.aat1780
微管在維持細(xì)胞形狀,、啟動(dòng)某些形式的運(yùn)動(dòng),、促進(jìn)胞內(nèi)轉(zhuǎn)運(yùn)和在有絲分裂期間分離染色體方面發(fā)揮著重要的作用,。每個(gè)微管是由十三條平行的微管蛋白原絲組成的空心圓柱體。
tau蛋白有助于讓微管保持穩(wěn)定和成束地組裝它們,。突變或翻譯后修飾,,比如降低tau蛋白對(duì)微管的親和力的高度磷酸化,被認(rèn)為導(dǎo)致tau蛋白纏結(jié)物形成,。
在一項(xiàng)新的研究中,,來(lái)自美國(guó)勞倫斯伯克利國(guó)家實(shí)驗(yàn)室和加州大學(xué)伯克利分校的研究人員利用低溫電鏡技術(shù)對(duì)結(jié)合到微管上的天然的全長(zhǎng)的成熟的tau蛋白進(jìn)行成像,成像整體分辨率為4.1埃,。他們證實(shí)tau蛋白沿著微管蛋白原絲(tubulin protofilament)縱向結(jié)合著,,這一發(fā)現(xiàn)與之前的低分辨率低溫電鏡研究相一致。相關(guān)研究結(jié)果于2018年5月10日在線發(fā)表在Science期刊上,,論文標(biāo)題為“Near-atomic model of microtubule-tau interactions”,。論文通信作者為勞倫斯伯克利國(guó)家實(shí)驗(yàn)室分子生物物理學(xué)與綜合生物成像部門(mén)資深科學(xué)家Eva Nogales。
tau蛋白是一種內(nèi)在無(wú)序的蛋白,,包括一個(gè)突出結(jié)構(gòu)(projection domain)域,,一個(gè)含有4個(gè)不完整重復(fù)序列的微管結(jié)合區(qū)和一個(gè)羧基端結(jié)構(gòu)域。作為一種二聚體,,微管蛋白是由α-微管蛋白和β-微管蛋白緊密連接在一起形成的,。微管蛋白二聚體通過(guò)首尾相連形成組成微管的微管蛋白原絲。
鑒于大量的文獻(xiàn)都未報(bào)道tau蛋白的結(jié)構(gòu),,人們并不確定它實(shí)際上是否會(huì)與微管蛋白發(fā)生有序的相互作用,。
為了測(cè)試關(guān)于tau蛋白的哪些氨基酸殘基參與與微管蛋白結(jié)合的假設(shè),這些研究人員構(gòu)建出含有由4個(gè)相同的重復(fù)序列組成的微管結(jié)合區(qū)的合成tau構(gòu)建物(synthetic tau construct),,并對(duì)這些與微管結(jié)合在一起的tau構(gòu)建物進(jìn)行成像觀察(整體分辨率為3.2~3.9埃),。Nogales實(shí)驗(yàn)室博士后研究員Simon Poepsel之前作為研究生時(shí)就已研究了tau的淀粉樣蛋白形式,并且在純化和制備用于低溫電鏡觀察的樣品中發(fā)揮著重要的作用,。
Nogales實(shí)驗(yàn)室博士后研究員Elizabeth Kellogg說(shuō),,“當(dāng)我們終觀察到tau蛋白中的重復(fù)序列長(zhǎng)度并且發(fā)現(xiàn)它具有確定的結(jié)構(gòu)和結(jié)合位點(diǎn)時(shí),我們意識(shí)到tau蛋白實(shí)際上與微管蛋白表面形成特定的相互作用,。當(dāng)我們能夠讓這一發(fā)現(xiàn)與這種重復(fù)序列的長(zhǎng)度和我們已有的這種序列信息保持一致時(shí),,我們的關(guān)鍵就在于要弄清楚如何充分地對(duì)這種結(jié)構(gòu)重建進(jìn)行改進(jìn)以便實(shí)現(xiàn)原子建模。”
這些研究人員尋求了Rosetta的幫助,。Rosetta是一套全面的計(jì)算建模工具,,用于根據(jù)氨基酸序列信息(如構(gòu)象和低能量狀態(tài))預(yù)測(cè)大分子的三維原子結(jié)構(gòu)。
Nogales解釋道,,這些高分辨率的低溫電鏡圖片讓他的團(tuán)隊(duì)能夠?qū)@種分子復(fù)合物的整體形狀進(jìn)行限制,,從而提高了這種結(jié)構(gòu)模型的保真度。
針對(duì)兩種不同的合成tau構(gòu)建物的Rosetta結(jié)構(gòu)預(yù)測(cè)都指向一個(gè)相同的解決方案:橫跨3個(gè)微管蛋白單體的27個(gè)氨基酸殘基的骨架區(qū)段。Nogales說(shuō),,“來(lái)自兩張獨(dú)立的結(jié)構(gòu)圖的相同序列寄存器和原子細(xì)節(jié)強(qiáng)調(diào)了我們的這個(gè)解決方案的穩(wěn)健性,,并為我們的原子模型的準(zhǔn)確性提供了高度的信心。”
Kellogg說(shuō),,“我們的結(jié)構(gòu)顯示了tau蛋白與微管表面的主要接觸位點(diǎn)是如何處于微管蛋白亞基之間的界面上,,起著促進(jìn)微管蛋白亞基之間結(jié)合的‘訂書(shū)釘’的作用,并解釋tau蛋白如何促進(jìn)微管穩(wěn)定性,。這種該結(jié)構(gòu)還解釋了tau蛋白磷酸化如何導(dǎo)致它從微管上脫離下來(lái),。”
人們已觀察到位點(diǎn)262處的絲氨酸磷酸化(在tau蛋白的重復(fù)序列中普遍保守)會(huì)減弱微管結(jié)合并且是阿爾茨海默病的一種標(biāo)志物。這種結(jié)構(gòu)模型表明在這個(gè)關(guān)鍵的錨定點(diǎn)發(fā)生磷酸化會(huì)破壞tau蛋白和微管之間的相互作用,,從而導(dǎo)致“這些訂書(shū)釘脫落”,。這些研究人員還鑒定了在tau蛋白-微管結(jié)合中起著至關(guān)重要作用的其他氨基酸殘基。(生物谷)
 您好, 歡迎來(lái)到化工儀器網(wǎng)
您好, 歡迎來(lái)到化工儀器網(wǎng)

會(huì)員.png) 12
12


