聯(lián)系電話
- 聯(lián)系人:
- 菲羅門
- 電話:
- 020-22826668
- 手機:
- 售后:
- 020-22826668
- 傳真:
- 020-28098130
- 地址:
- 廣州市天河北路179號尚層國際13樓
- 網址:
- www.gzflm.com
掃一掃訪問手機商鋪
蛋白質/多肽液相分析中的流動相選擇
有機溶劑可將吸附在疏水界面的蛋白質洗脫(圖14),。
在梯度洗脫期間,當有機溶劑量達到針對每一蛋白質的特定濃度時,,蛋白質就會從疏水界面上解吸,,繼續(xù)順著柱向下,從而從柱中洗脫。
圖14. 當有機改性劑的濃度達到特定值時,,蛋白質從疏水界面洗脫,。
乙腈。在多肽的反相色譜分離時常用的有機溶劑為乙腈,。為什么選擇乙腈,?
乙腈易揮發(fā),易從樣品中去除,。
乙腈黏度低,,柱壓低。
乙腈的紫外吸收截止波長較短,。
乙腈長期用于分離應用,。
異丙醇。異丙醇在多肽的色譜分離中具有重要作用,。盡管異丙醇黏度大(會增大柱壓),,很少單獨用作有機改性劑,但其在提高一些多肽的回收率方面具有重要作用,,尤其是強疏水性蛋白,。
在此類情況下,以1%~5%的恒定濃度加入異丙醇,,以提高疏水性多肽的回收率或洗脫,。
其它有機改性劑。很少使用甲醇或乙醇等有機改性劑,,除非在分離強疏水性蛋白時,。此外,由于乙醇毒性低,,因此還用于蛋白質的大規(guī)模純化,。
梯度洗脫。多肽的洗脫幾乎都采用梯度洗脫法,,采用梯度洗脫法分離時,,逐漸增大有機溶劑的相對濃度。
當有機改性劑的濃度升到解吸所需的特定濃度時,,蛋白質和多肽就從柱上洗脫,。如圖15所示,有機改性劑的濃度(梯度)變化速率越慢,,這些蛋白亞基的分辨率越高,。
在該例中,相較于每分鐘0.5%的梯度變化速率,,每分鐘0.25%的梯度變化顯著提高了分辨率,。
蛋白質/多肽的保留機制的圖1中顯示了采用每分鐘0.15%的梯度變化速率時幾種胰島素的分離過程,。采用每分鐘0.05%的梯度變化速率洗脫時,分辨率大,。
圖15. 一般情況下,,降低有機溶劑濃度變化速率會提高分辨率。
A. 細胞色素c亞基
B. 色譜圖A中間片段的重現(xiàn),。
色譜柱:C4 寬孔柱,, 4.6 x 250 毫米
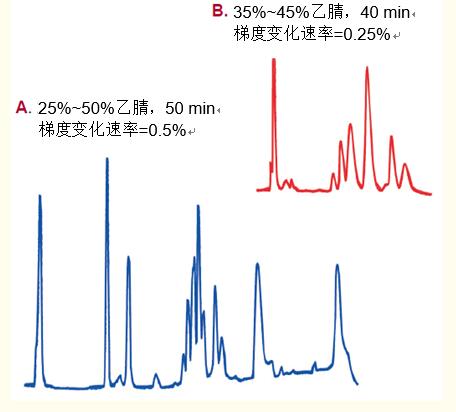
降低梯度變化速率增加分辨率時,所需的分析時間必須盡可能短,。
但是,,梯度變化速率的調整在優(yōu)化蛋白質和多肽的分辨率方面非常重要。
有時,,降低梯度變化速率時,,多肽會表現(xiàn)出特異行為(圖16)。
分辨率有時不會按照預期增加,,反而會降低,導致出現(xiàn)共洗脫,,甚至洗脫順序也會顛倒,。
在圖16的示例中,洗脫時間為45分鐘時多肽11和12表現(xiàn)出蕞佳的分離效果,。
當洗脫時間增加至90分鐘時,,多肽11和12間的分辨率降低;而當洗脫時間增加至160分鐘時,,出現(xiàn)共洗脫峰,。
這種保留行為是多肽表面相互作用的結果,導致這種行為的原因目前尚不清楚,。
因此,,在進行多肽分離時,尤其是在分離蛋白酶水解物時,,觀察分辨率隨梯度坡度降低的變化很重要,。
如果分辨率未增加,反而降低,,則必須優(yōu)化梯度變化速率,,以大化整體分辨率。
圖16. 多肽間分辨率有時隨著溶劑濃度變化速率的降低(洗脫時間增加)而降低,。
這將導致分辨率降低或共洗脫峰的出現(xiàn),,如人生長激素肽圖中多肽11和12例示。
在一些情況下,,多肽甚至會逆轉洗脫順序,。
樣品人生長激素的胰蛋白酶水解物,。部分顯示了多肽圖譜。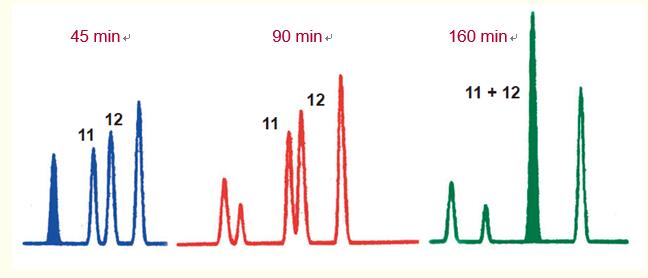
色譜柱:C18寬孔柱,,4.6 x 150 mm
洗脫液:梯度:0~60%乙腈與水溶性溶劑和0.1%TFA混合液和有機溶劑與0.08%TFA混合液在一定時間內形成梯度洗脫,。
蛋白質和多肽的反相色譜分析法需要“離子對試劑”。
在流動相中加入離子對試劑,,以實現(xiàn)良好的峰形,。
目前認為,在沒有離子對試劑的情況下,,硅膠表面的金屬雜質是導致蛋白質/多肽峰形較差的原因,。
三氟yi酸。三氟yi酸(TFA)是常用的離子對試劑,。將濃度為~0.1%的三氟yi酸加入流動相,,會在大多數(shù)柱上產生良好的峰形(圖17)。
降低TFA的濃度能提高LC-MS的檢測靈敏度(見22~25頁),,但由于硅膠表面存在雜質,,可能會導致硅膠柱上的峰形較差。
但采用高純度硅膠柱時,,可加入低濃度TFA(圖17A——0.01% TFA),。
圖17. TFA濃度對峰形和選擇性的影響
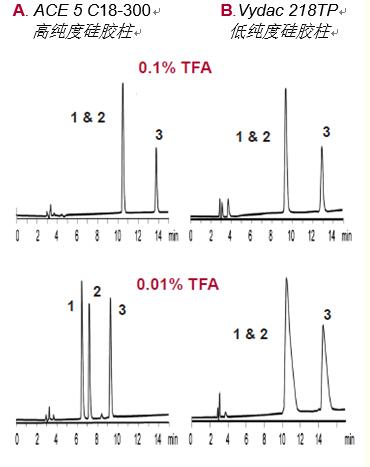
洗脫液:加入如圖所示的TFA,以20%~32%的乙腈(ACN)梯度洗脫,,洗脫時間為15分鐘,。
樣品1.血管緊張素II 2.血管緊張素III3.血管緊張素I
其它離子對試劑。盡管目前為止TFA仍是常用的離子對試劑,,但蛋白質/多肽分離有時會采用磷酸和七氟丁酸(HFBA)等其它試劑,。
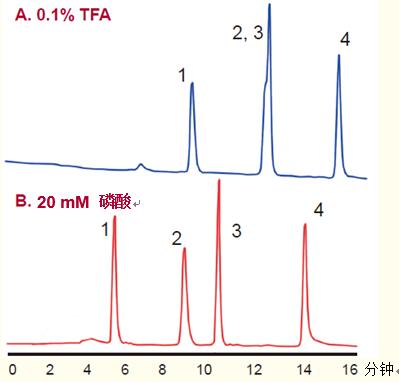
如圖18所示,一些情況下,,磷酸可分離一些TFA無法分離的多肽,。通常磷酸鹽使用濃度約為20-30 mM,pH為2~2.5,。此外,,磷酸鹽緩沖液對一些蛋白質的分離效果要優(yōu)于TFA。
盡管同TFA一樣,,磷酸鹽緩沖液使用的pH通常較低,,但磷酸鹽緩沖液也能適應較高的pH,為選擇性和分辨率的改變提供了機會(見17頁),。
將磷酸鹽作為離子對試劑的主要弊端是:磷酸鹽不揮發(fā),,很難從肽中去除。
一些時候,,七氟丁酸用作組蛋白等堿性蛋白分離的離子對試劑
圖18. 使用除TFA以外的離子對試劑可能會產生不同的選擇性
條件
色譜柱:C18 寬孔柱,, 4.6 x 250 毫米
洗脫液:
A.4%~40% 乙腈—0.1%TFA體系,,pH=2,18分鐘梯度洗脫。
B.4%~40% 乙腈—20mM 磷酸體系,,pH=2,18分鐘梯度洗脫,。
樣品:
緩激肽
神經降壓素
蛙皮素
章魚唾腺精
pH值對多肽保留行為的影響。不論采用TFA和磷酸,,還是其它離子對試劑,,用于多肽分離的反相流動相通常適應的pH值較低。
在低pH值條件下,,羧酸基團——端羧基,,以及天冬氨酸和谷氨酸的側鏈會進行質子化,且僅有輕微極性,。
將流動相的pH值增加至6~7將會使羧酸基團離子化,,減弱多肽的疏水性。這將降低各種多肽的保留值,,但尤其影響含天冬氨酸或谷氨酸的多肽(圖19),。
與其它多肽相比,含天冬氨酸和谷氨酸的多肽的保留值降低更多,,從而改變了選擇性,。盡管增加多肽分離流動相pH的做法不經常采用,但它可以在一些特定情況下發(fā)揮作用,。
圖19. 流動相的pH值會影響多肽的保留值,尤其是含酸性氨基酸殘基(天冬氨酸和谷氨酸)的多肽,。
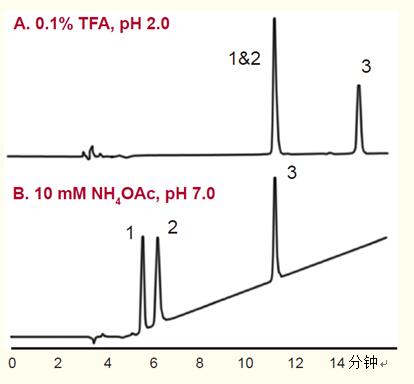
條件
色譜柱:ACE 5 C18-300,,4.6 x 250 mm
洗脫液:
A.20%~32% 乙腈—0.1%TFA體系,pH=2,15分鐘梯度洗脫,。
B.20%~32% 乙腈—10mM NH4OAc體系,,pH=7,15分鐘梯度洗脫。
樣品
血管緊張素II
血管緊張素III
血管緊張素I
流速,。流動相的流速對反相液相色譜法分離的分辨率影響不大,。
如圖20所示,流動相流速為0.5,、1.0或2.0 ml/min時,,胰蛋白酶圖譜中多肽的分辨率大致相同。
但梯度體積必須恒定才能維持分辨率一致,。
這需要隨著流速的增加減少梯度洗脫時間,。
體系壓力隨著流速的增加而增加;體系壓力可能會限制可用的流速,。
此外,,較高的流速還會使檢測靈敏度稍有降低,,但可能增加大分子蛋白或疏水性蛋白的溶解度。
圖20. 流動相的流速對多肽的分辨率影響不大,。隨著流速的變化,,總梯度體積必須保持恒定才能維持分辨率一致。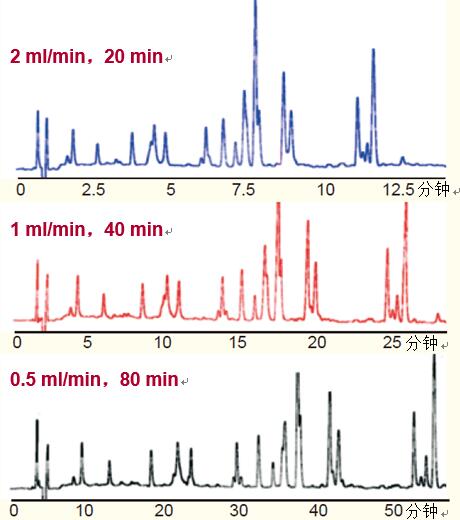
條件
色譜柱:C18小孔柱,,4.6 x 250 mm
洗脫液:10%~50% 乙腈~0.1% TFA 體系,,時間、流速如圖所示
樣品β-乳球蛋白的胰蛋白酶水解物

 初級會員·11年
初級會員·11年
