免疫組織化學(簡稱免疫組化)是組織化學的一種,,它是利用已知的特異性抗體與抗原能特異性結(jié)合的特點,通過化學反應(yīng)使標記于結(jié)合后的特異性抗體上的顯示劑,,如酶,、金屬離子、同位素等,,顯示一定的顏色,,并借助顯微鏡觀察其顏色的變化,從而在抗原抗體結(jié)合部位確定組織、細胞結(jié)構(gòu)的化學成份或化學性質(zhì),。
實驗過程包括切片制作(固定,,脫水,透明,,包埋,,切片,貼片,,烤片),,脫蠟,水化,,阻斷,,抗原修復(fù),封閉,,一抗孵育,,二抗孵育,顯色,,復(fù)染,,封片,分析,。

IHC是一項具有挑戰(zhàn)性的應(yīng)用技術(shù),,應(yīng)用過程中常出現(xiàn)各種問題,例如檢測結(jié)果陰性,,非特異性染色,染色強度不夠,,著色不均,,脫片,干片等,。因此索萊寶為大家總結(jié)了一些IHC常見問題及處理方法,,來幫助您改進IHC檢測,減少您的實驗優(yōu)化過程,,快速達到預(yù)期結(jié)果,。
IHC常見問題
Q
固定液的選擇
A:
a)甲醛:甲醛是保留組織和細胞內(nèi)蛋白靶點的常用固定劑,是大多數(shù)IHC/ICC應(yīng)用的良好選擇,,但并不是一種通用的固定劑,。醛的過度固定會修飾氨基酸(屬于表位中的一部分),并阻斷抗體與之結(jié)合,。然而大部分情況下,,利用抗原修復(fù)技術(shù)可暴露表位,以還原抗體結(jié)合。研究表明甲醛會誘導(dǎo)磷酸化依賴表位的細胞內(nèi)轉(zhuǎn)位,,從細胞膜轉(zhuǎn)移至細胞質(zhì),。在這種情況下,冰預(yù)冷的無水甲醇或無水乙醇是適當?shù)奶娲?/p>
b)醇類:常用于細胞和組織固定的醇類是甲醇和乙醇,。通常認為醇類不像甲醛固定劑那樣保留組織形態(tài),,不像甲醛那樣滲透,主要用于固定冰凍組織切片和細胞,。在醇類固定之后不推薦進行抗原修復(fù),。
c)丙酮:丙酮是一種強的脫水劑,能引起組織蛋白的不可逆沉淀,。它常用于未固定,、快速冷凍組織的切片。
Q
細胞和組織常用的固定方法
A:
a)培養(yǎng)細胞:培養(yǎng)細胞的固定時間與組織相比較短,,且固定液的濃度更低,。例如,用2%甲醛溶液在室溫下固定20min,,足以保留細胞形態(tài)和抗原性,。
培養(yǎng)細胞的固定通常只是去除培養(yǎng)基,并加入固定液即可,。不過,,去除培養(yǎng)基后表面張力的變化可能損害某些細胞類型。如果是這種情況,,固定劑可直接加入培養(yǎng)基中,。例如,加入與培養(yǎng)基相同體積的4%甲醛,,將得到2%甲醛溶液,,它足以預(yù)固定細胞。2min后,,預(yù)固定培養(yǎng)基應(yīng)當替換成新鮮的2%固定劑,。預(yù)固定步驟讓細胞更加堅硬,這樣它們就能夠承受表面張力改變所引起的任何可能的有害影響,。
b)組織:對于小組織來說,,浸入固定溶液通常能獲得足夠的固定??蓪⒔馄实慕M織浸潤在固定劑中,,但是如果將固定溶液經(jīng)由內(nèi)循環(huán)系統(tǒng)(無論是通過心臟或通過腹主動脈)灌注,則往往能獲得更快速,、更均勻的固定,。在研究小動物的完整組織時,,灌注固定是保留抗原的佳方法,包括用固定液來取代動物的全身血液,。4%甲醛是組織灌注和浸潤固定的常用溶液,。
為了在浸潤固定過程中加強固定劑的滲透,建議組織厚度不超過5mm,。對于完整的固定,,固定劑的體積應(yīng)當是組織體積的50-100倍。固定通常在室溫下進行4-24小時,。由于固定不足或固定過度可能降低或破壞組織的免疫反應(yīng)性,,因此優(yōu)化條件很重要。
Q
抗原修復(fù)方法
A:
由于組織在甲醛或多聚甲醛固定過程中,,發(fā)生了蛋白之間交聯(lián)及醛基的封閉作用,,從而掩蓋抗原決定簇,通過抗原修復(fù),,使得細胞內(nèi)抗原決定簇重新暴露,,提高抗原檢測率。常用的修復(fù)方式一般分三種:高壓修復(fù),、微波修復(fù),、酶修復(fù)。
a)高壓修復(fù)是目前使用較多,、較穩(wěn)定,、可重復(fù)性較高的一種方法,操作簡單,,效果較好,。但這種方法對修復(fù)的溫度和時間要求十分嚴格。我們常用的高壓鍋修復(fù),,溫度在110℃左右,,修復(fù)時間為2.5min。
b)微波修復(fù)是較早采用的熱抗原修復(fù)技術(shù),,其方法受環(huán)境因素影響較大,。微波修復(fù)偶爾也會出現(xiàn)同時修復(fù)的組織切片中以及同一切片的不同部位可能會出現(xiàn)修復(fù)效果不均勻的現(xiàn)象,。比較適合高pH值的抗原修復(fù)液(EDTA,、EGTA)修復(fù)。
c)酶修復(fù)法比較溫和,,常用于脫片現(xiàn)象較嚴重的切片(如骨組織切片),。常用的酶有胰蛋白酶、胃蛋白酶,、蛋白酶K等,。酶消化法進行抗原修復(fù),,須嚴格控制濃度和作用時間,消化不足,,不能充分暴露出組織抗原,;過度的消化會破壞組織結(jié)構(gòu),陽性定位不明確,。我們常用蛋白酶K修復(fù),,條件為37℃ 10min。
Q
為什么要滅活內(nèi)源性過氧化物酶活性,?
A:
內(nèi)源性過氧化物酶會與基質(zhì)溶液(過氧化氫和顯色劑,,例如DAB)發(fā)生反應(yīng),導(dǎo)致假陽性,。在與HRP偶聯(lián)抗體一起孵育之前,,先用過氧化氫預(yù)處理樣本可以顯著降低這種非特異性背景。滅活內(nèi)源性過氧化物酶一般用3%過氧化氫孵育10min左右,。
Q
IHC實驗中有脫片現(xiàn)象
A:

Q
IHC染色出現(xiàn)定位不準確現(xiàn)象
A:
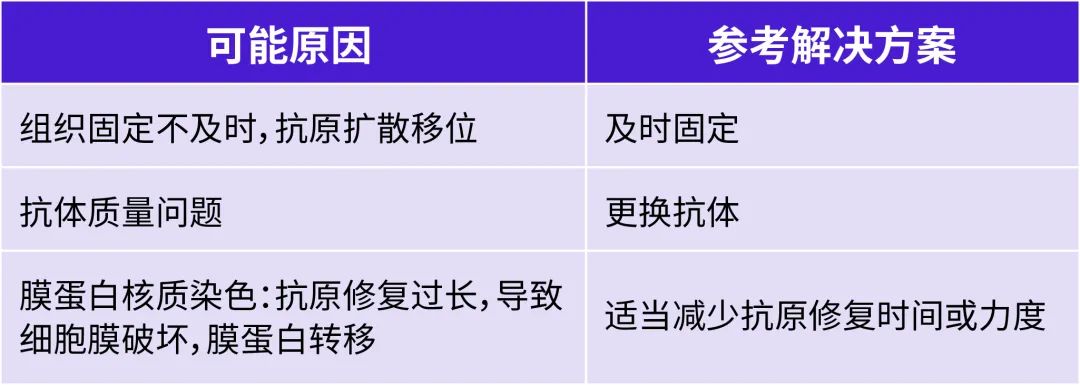
Q
染色后有邊緣效應(yīng)
A:
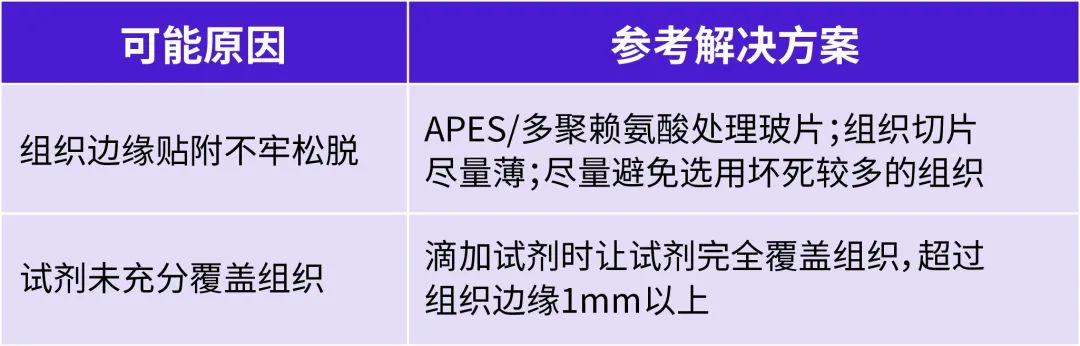
Q
IHC實驗存在非特異性染色或顯色過度
A:
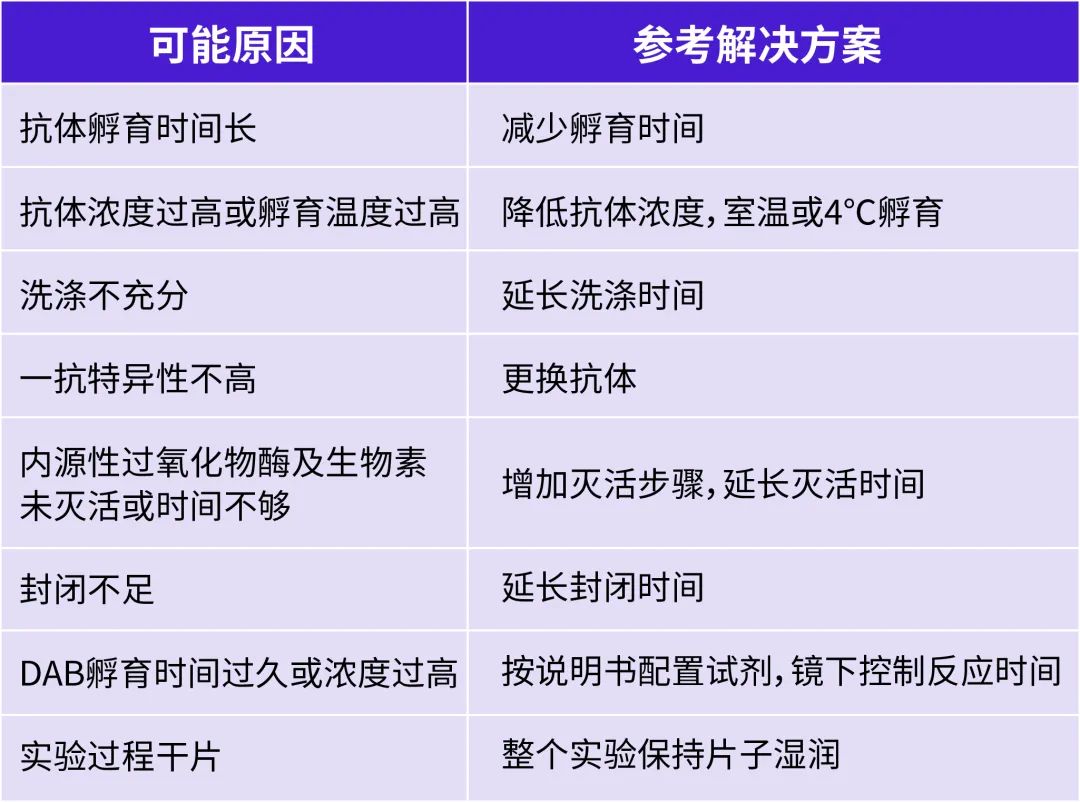
Q
IHC染色結(jié)果顯色較弱
A:

Q
IHC實驗染色結(jié)果是陰性
A:
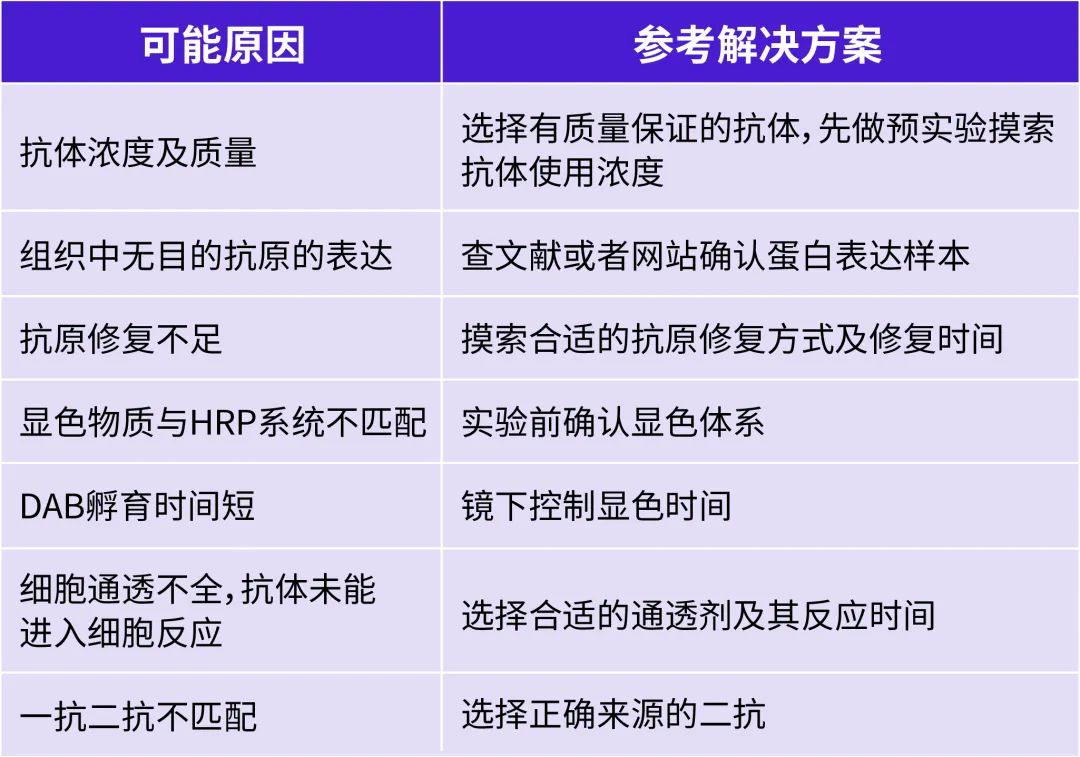
Q
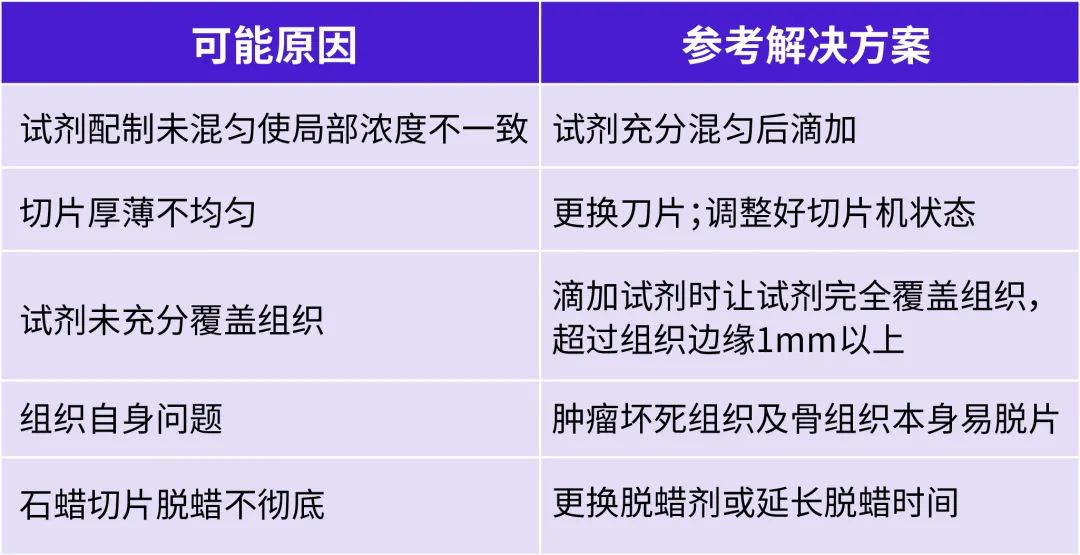
IHC實驗染色不均勻
A:

立即詢價
您提交后,專屬客服將第一時間為您服務(wù)