在免疫抑制的TME中,高水平的乳酸通過促進腫瘤相關(guān)巨噬細胞(TAM)表型向M2型極化和抑制CD8+T細胞活性來促進腫瘤細胞免疫逃逸,。因此,,腫瘤源性乳酸作為免疫抑制TME的免疫調(diào)節(jié)因子,是未來有潛力的腫瘤免疫治療靶點,。作為一種單羧酸轉(zhuǎn)運體(MCT),,沉默MCT-4的表達可以增加細胞內(nèi)乳酸含量來誘導腫瘤細胞凋亡,并降低細胞外乳酸含量來調(diào)節(jié)TME,。聯(lián)合化療和抑制乳酸外排可能具有良好的體內(nèi)抗腫瘤療效,。
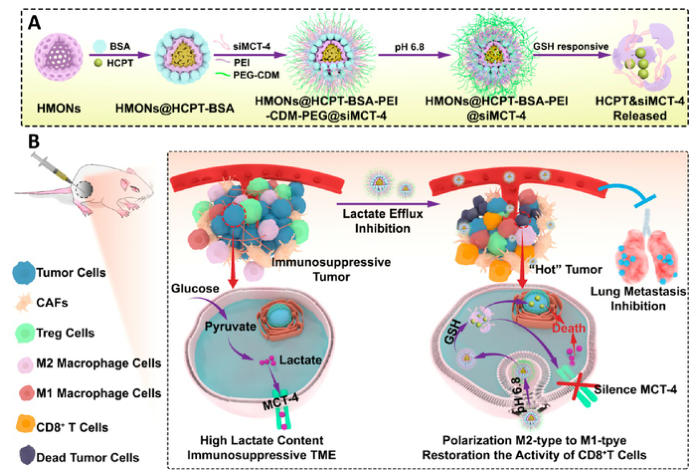
響應(yīng)谷胱甘肽(GSH)的生物可降解介孔有機硅納米顆粒(MONs)是抗癌藥物傳遞的候選材料之一,通常采用二硫鍵(−S-S-)作為中間連接劑來制備硅網(wǎng)絡(luò),?;谇叭搜芯匡@示的中空MONs(HMONs)巨大的應(yīng)用潛力,作者尋求將可生物降解的HMONs作為一種多用途的納米給藥平臺,,用于協(xié)調(diào)化療和免疫治療,,以獲得更大的治療效益。
重慶大學蔡開勇教授和西南大學羅忠教授團隊提出了通過抑制乳酸外流和化療的聯(lián)合作用,,消除免疫抑制性TME,,將免疫抑制性腫瘤轉(zhuǎn)化為“熱”性腫瘤,,并取得佳抗腫瘤療效的有效策略。通過在血液循環(huán),、腫瘤攝取和細胞內(nèi)釋放的順序遞送階段調(diào)控激活,,納米平臺可以提供平衡的安全性和治療性能。此外,,納米平臺可以誘導免疫促進因子的表達,,并激活免疫應(yīng)答來抑制肺轉(zhuǎn)移。

基本信息
題目:
Engineering of Cascade-Responsive Nanoplatform to Inhibit Lactate Efflux for
Enhanced Tumor Chemo-Immunotherapy
期刊:ACS NANO
影響因子:14.588
PMID:32975406
通訊作者:蔡開勇教授和羅忠教授為共同通訊作者
作者單位:重慶大學和西南大學
索萊寶合作產(chǎn)品:
產(chǎn)品名稱 | 產(chǎn)品貨號 |
ANNEXIN V- FITC/PI 凋亡檢測試劑盒 | CA1020 |
摘 要
乳酸作為腫瘤中高速有氧糖酵解的增加產(chǎn)物,,可以調(diào)節(jié)免疫抑制的腫瘤微環(huán)境(TME),。將羥基喜樹堿(HCPT)和siMCT-4負載于經(jīng)PEG-CDM表面修飾的、GSH響應(yīng)型中空介孔有機二氧化硅納米平臺,,用于協(xié)同腫瘤化療免疫治療,。此納米平臺對腫瘤細胞弱酸性TME和高水平GSH有級聯(lián)反應(yīng)。HCPT和siMCT-4從納米平臺持續(xù)釋放,,用于化療和抑制細胞內(nèi)乳酸外流,。細胞內(nèi)乳酸和HCPT升高可有效誘導腫瘤細胞凋亡。而細胞外乳酸的降低使腫瘤相關(guān)巨噬細胞(TAMS)的表型由M2型轉(zhuǎn)變?yōu)镸1型,,并恢復了體內(nèi)CD8+T細胞的活性,。結(jié)果表明,納米平臺通過抑制乳酸外流與化療聯(lián)合作用,,有效地清除了免疫抑制TME,,抑制了腫瘤生長,且抑制了B16F10細胞和4T1細胞的肺轉(zhuǎn)移,。這是一種將免疫抑制腫瘤轉(zhuǎn)化為“熱”瘤,,并在體內(nèi)高效抑制腫瘤生長的策略。
研究內(nèi)容及結(jié)果
1.響應(yīng)GSH降解的納米顆粒的合成與表征
首先在前人研究的基礎(chǔ)上合成了固體二氧化硅納米顆粒(記為sSiO2 NPs),。之后,,以sSiO2 NPs為基礎(chǔ)合成了中空介孔有機硅納米顆粒(命名為HMONs)。BSA用于阻斷裝載在HMONs中的HCPT(HMONs@HCPT-COOH),,以降低納米顆粒對正常細胞的細胞毒性,。實驗表明,BSA能穩(wěn)定地在HMONs表面組裝,。
為了有效的加載siMCT-4,,PEI被裝載到HMONs@HCPT-BSA-COOH的表面。后,,將PEG-CDM引入HMONs@HCPT-BSA-PEI表面,,延長血液循環(huán)時間。實驗表明成功合成了GSH降解中空介孔有機硅納米膠囊和PEG化PEI功能化BSA封阻的HMONs(HMONs@HCPT-BSA-PEI-CDM-PEG),。
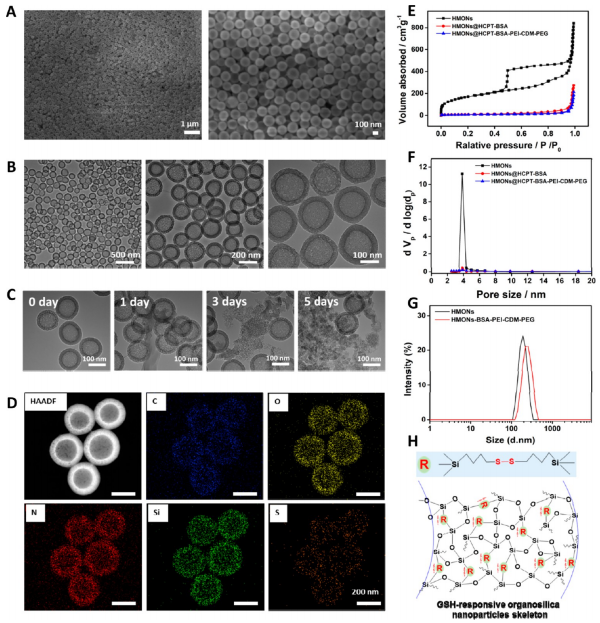
圖1
2. 響應(yīng)GSH的藥物釋放和納米顆粒吞噬
由于實體瘤的這種異常代謝,,腫瘤細胞內(nèi)會積累高劑量的還原性谷胱甘肽,。基于實體腫瘤的特點,,設(shè)計了一個納米藥物和siRNA傳遞系統(tǒng),,其具有弱酸性和GSH響應(yīng)性(HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4)。HCPT釋放結(jié)果表明(圖2A),,納米平臺具有良好的GSH響應(yīng)能力,。采用流式細胞術(shù)(FCM)(圖2B)和激光共聚焦掃描顯微鏡(CLSM)(圖2C,D)對納米顆粒的吞噬作用進行表征,。由于CDM鍵的斷裂,,暴露PEI可以增強B16F10的細胞攝取功效。PEG-CDM組對腫瘤微環(huán)境的弱酸反應(yīng)并暴露PEI組,。B16F10細胞呈現(xiàn)強正電荷促進吞噬作用,,這與其他研究一致。在腫瘤細胞中,,納米藥物和siRNA傳遞系統(tǒng)持續(xù)釋放化療藥物HCPT和siMCT-4,用于協(xié)同腫瘤化療免疫治療,。
通過瓊脂糖凝膠阻滯試驗驗證納米顆粒負載siRNA的效果,。結(jié)果表明,當納米顆粒與siRNA的重量比(w:w)為10:1時,,siRNA可以*負載,。終的重量比為20:1,以供進一步研究,。通過免疫熒光(圖2E)和Western blotting實驗(圖2F)驗證了負載siMCT-4的納米顆粒對B16F10細胞中MCT-4表達的影響,。結(jié)果表明,與其他組相比,,負載siMCT-4的納米顆粒能有效抑制MCT-4的表達,。
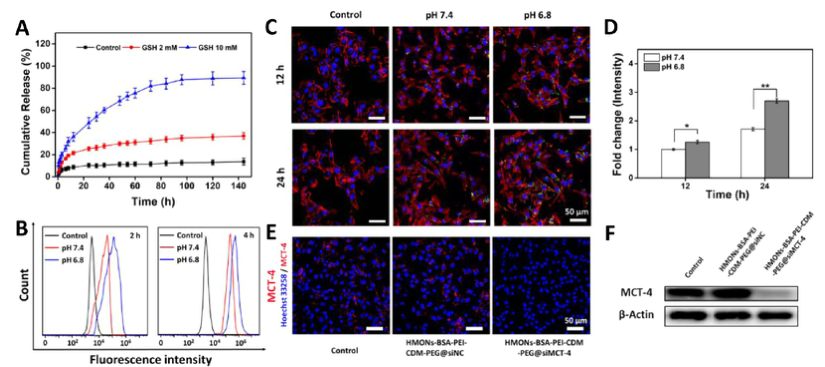
圖2
3.乳酸對體外巨噬細胞極化的影響
通過RAW264.7細胞與腫瘤細胞(B16F10細胞和4T1細胞)共培養(yǎng)實驗,驗證乳酸對體外巨噬細胞表型極化的影響(圖3A),。Western blotting檢測結(jié)果表明,,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4顯著沉默了B16F10細胞和4T1細胞中MCT-4的表達(圖3B)。經(jīng)HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4處理后,,共培養(yǎng)液(RAW264.7細胞與B16F10細胞共培養(yǎng))中的細胞外乳酸含量較其他處理低(圖3C),。同時,B16F10細胞的胞內(nèi)乳酸含量高于其他處理(圖3D),。以上結(jié)果與RAW264.7細胞與4T1細胞共培養(yǎng)模型的結(jié)果高度一致,。上述實驗結(jié)果證明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4可以抑制MCT-4的表達,,并進一步抑制B16F10細胞和4T1細胞的乳酸外流,。
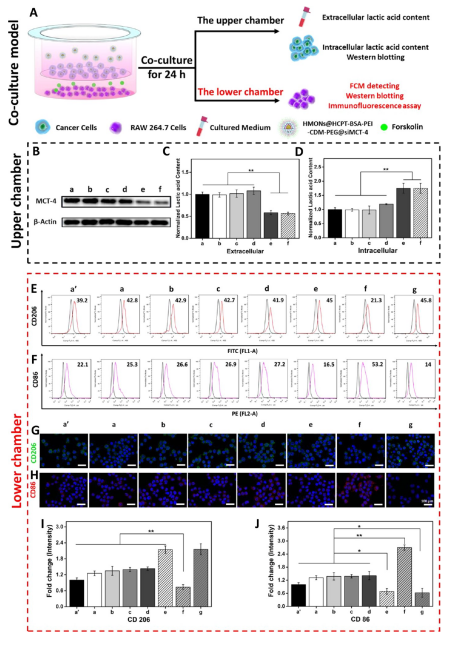
圖3
流式細胞儀檢測M1型標記物CD86和M2型標記物CD206的表達,。結(jié)果提示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組M1型巨噬細胞比例明顯增加。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+forskolin組CD86表達下調(diào),,CD206表達上調(diào),。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+乳酸組也表現(xiàn)出與HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組相反的趨勢,說明培養(yǎng)基中的乳酸在巨噬細胞表型極化中起著重要作用,。此外,,與僅用DMEM培養(yǎng)基組相比,B16F10或4T1細胞共培養(yǎng)組中CD86和CD206的表達略有上調(diào)(圖3E,,F(xiàn)),。采用免疫熒光法檢測不同處理后CD86和CD206的表達情況。從CLSM圖像中可以看到HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組CD86表達明顯增加,,CD206表達明顯減少(圖3G,,H)。其他組的結(jié)果及相關(guān)熒光定量統(tǒng)計(圖3I,,J)與FCM檢測結(jié)果趨勢一致,。以上結(jié)果表明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在體外通過抑制乳酸外流顯著誘導RAW264.7細胞表型向M1型極化,。
4.納米平臺的細胞活力和細胞毒性評價
本研究中,,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在體外可顯著抑制B16F10和4T1細胞活力,誘導腫瘤細胞凋亡,。Western blotting檢測不同處理后細胞凋亡相關(guān)蛋白的表達,。WB結(jié)果顯示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4組顯著誘導B16F10細胞和4T1細胞中Bax的表達,但Bcl-2的表達受到抑制(圖4A),,蛋白灰度定量統(tǒng)計結(jié)果一致(圖4B),。結(jié)果顯示,兩組均具有較高的細胞毒性,,可顯著誘導腫瘤細胞凋亡,。與其他組相比,也顯著抑制了B16F10和4T1細胞活力(圖4C),。為了進一步研究負載HCPT和siMCT-4的納米平臺的細胞毒性,,作者使用Annexin V-FITC/PI細胞凋亡試劑盒確認不同處理后的細胞毒性(圖4D)。流式細胞術(shù)檢測結(jié)果提示兩組均能誘導腫瘤細胞凋亡,,且有時間依賴性,。HMONs-BSA-PEI-CDM-PEG具有輕微的細胞毒性。
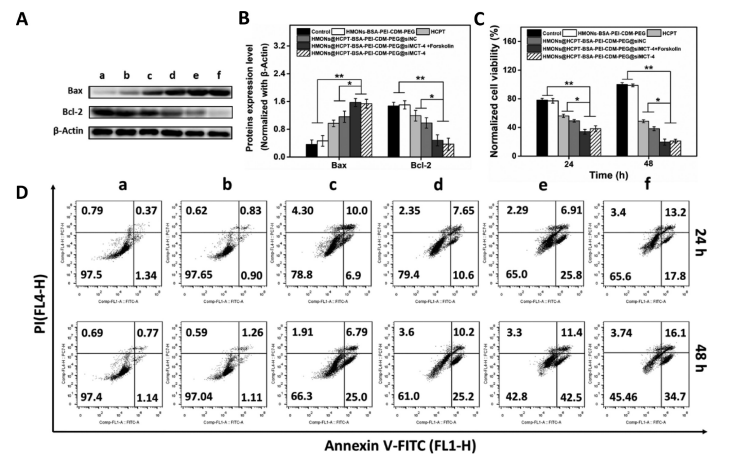
圖4
5.利用納米平臺通過抑制腫瘤細胞內(nèi)乳酸外流激活巨噬細胞M2到M1極化和恢復體內(nèi)T細胞活性
為了驗證MCT-4在體內(nèi)沉默的有效性,,我們在各種治療后處死B16F10或4T1荷瘤Balb/c小鼠,。對B16F10腫瘤組織(圖5A)和4T1腫瘤組織(圖5H)進行Western blotting檢測MCT-4的表達。結(jié)果顯示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組抑制了MCT-4的表達,。此外,,通過檢測腫瘤組織細胞中乳酸含量和TME中乳酸含量,,證明通過抑制乳酸在體內(nèi)的外流,腫瘤細胞中乳酸含量增加,,TEM中乳酸含量降低,。從相關(guān)結(jié)果(圖5C,D,,I,,J)中,作者發(fā)現(xiàn)HMONs@HCPT-BSA-PEI-CDM@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組顯著抑制了B16F10和4T1荷瘤小鼠的乳酸外流量,。
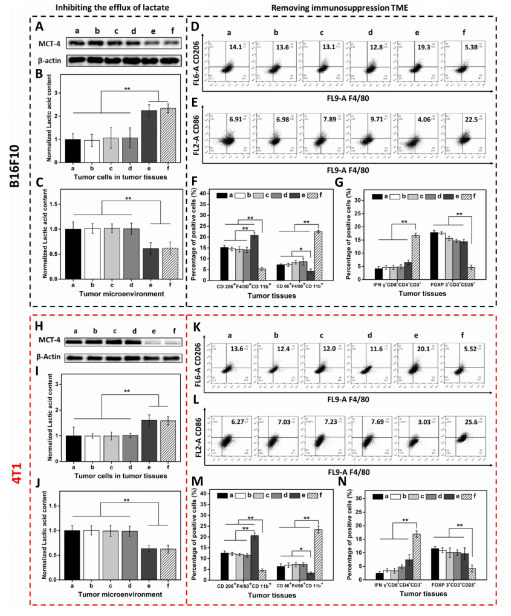
圖5
接下來作者研究了抑制乳酸外流對TAM表型極化和恢復體內(nèi)CD8+T細胞活性的影響,,結(jié)果表明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組明顯降低了M2型TAMs的百分比(圖5D,F(xiàn),,K,,M),同時增加了M1型TAMs的能力(圖5E,,F(xiàn),,L,M),。免疫熒光法檢測B16F10腫瘤組織中TAM標記物(CD11b),、M2型標記物(CD206)和M1型標記物(CD86)的表達。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組抑制了CD206的表達,,誘導了CD86的表達,這與B16F10腫瘤組織的FCM檢測結(jié)果一致,。檢測了B16F10或4T1腫瘤組織中Treg細胞的百分比,,驗證了工程化的納米平臺清除免疫抑制TME的效率。以上結(jié)果證實HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4在體內(nèi)通過抑制乳酸外流的作用,,有效地將TAMs的表型從M2型極化為M1型,,降低Treg細胞的百分比,恢復CD8+T細胞的活性,。
6.體內(nèi)對腫瘤組織免疫應(yīng)答的恢復及對肺腫瘤轉(zhuǎn)移的抑制
進一步討論抑制乳酸外流在免疫抑制TME和激活體內(nèi)免疫應(yīng)答中的作用,,相關(guān)結(jié)果表明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組的相關(guān)免疫細胞比例明顯高于其他組(圖6A,,B),,證明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在體內(nèi)通過抑制乳酸外流,顯著緩解免疫抑制TME,,激活免疫應(yīng)答,。采用免疫熒光法檢測B16F10腫瘤組織中的免疫促進因子(IFNγ、TNF-α)和免疫抑制因子(Arg1,、TGF-β),,分析其抗腫瘤作用機制,。根據(jù)CLSM圖像,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組顯著誘導免疫促進因子表達(圖6B),,降低免疫抑制因子表達(圖6D),。對應(yīng)的熒光定量統(tǒng)計(圖6H)與FCM和IF檢測結(jié)果趨勢一致。上述結(jié)果表明,,在免疫抑制TME中,,乳酸是主要的免疫調(diào)節(jié)因子。通過抑制乳酸外流可以有效地將免疫抑制型腫瘤轉(zhuǎn)化為“熱”型腫瘤,,在體內(nèi)實現(xiàn)免疫應(yīng)答,。

圖6
有研究表明,免疫抑制TME中乳酸含量與腫瘤細胞肺轉(zhuǎn)移密切相關(guān),。有報道使用Balb/c小鼠肺轉(zhuǎn)移模型來證明HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4對B16F10細胞和4T1細胞肺轉(zhuǎn)移的影響(圖6C),。經(jīng)不同處理后,肺組織圖像顯示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組明顯抑制肺轉(zhuǎn)移,,減少了B16F10細胞(圖6D,,E)和4T1細胞(圖6F,G)肺轉(zhuǎn)移結(jié)節(jié)的形成,。此外,,H&E染色結(jié)果還顯示HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4組B16F10細胞和4T1細胞通過抑制乳酸外流轉(zhuǎn)移到肺組織。
7.體內(nèi)抗腫瘤效能
利用B16F10和4T1荷瘤小鼠研究HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4在體內(nèi)的抗腫瘤效能(圖7A),。從圖7B的荷瘤圖像來看,,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組與其他組相比,腫瘤生長明顯受到抑制,。相關(guān)腫瘤體積(V/V0)結(jié)果(圖7C)與荷瘤小鼠圖像趨勢一致,。腫瘤組織重量結(jié)果顯示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4組體內(nèi)抗腫瘤效果好(圖7D)。進一步研究體內(nèi)腫瘤細胞的凋亡情況,,圖7E和F證實HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4組明顯誘導體內(nèi)腫瘤細胞凋亡,。相關(guān)的荷瘤生存率結(jié)果表明HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4具有顯著的抗腫瘤效果,并顯著延長荷瘤小鼠的生存時間,。
接下來揭示了HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4對Balb/c小鼠的生物相容性和細胞毒性,,荷瘤小鼠的體重證明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在體內(nèi)具有良好的生物相容性。此外,,HE染色圖像顯示HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4對主要臟器無毒副作用,,而HCPT組肝臟毒性較輕,這與其他研究一致,。
為了研究停止治療21天后腫瘤的復發(fā),,給4T1荷瘤小鼠用藥。從圖7E中4T1荷瘤小鼠的圖像來看,與其他組相比,,HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4組能顯著抑制腫瘤生長,。相關(guān)腫瘤體積(V/V0)結(jié)果(圖7F)與荷瘤小鼠圖像趨勢一致。腫瘤組織重量結(jié)果顯示,,HMONs@ HCPT-BSA-PEI-CDM-PEG@siMCT-4組抗腫瘤效果優(yōu)于其他組(圖7G),。相關(guān)的腫瘤體積(V / V0)證明了HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4組在停止治療后激活了免疫反應(yīng)而顯著抑制腫瘤復發(fā)。從這些結(jié)果來看,,HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4在體內(nèi)表現(xiàn)出良好的抗腫瘤效果,,明顯延長荷瘤小鼠的生存時間,并有效抑制腫瘤復發(fā),。

圖7
結(jié) 論
在本研究中,,作者構(gòu)建了一種納米藥物和siRNA傳遞系統(tǒng),用于消除免疫抑制TME,,抑制腫瘤生長,,減少腫瘤細胞在體內(nèi)的肺轉(zhuǎn)移。HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4納米平臺可顯著抑制MCT-4的表達并抑制乳酸外流,。與此同時,,納米藥物和siRNA系統(tǒng)通過體外抑制乳酸外流,顯著誘導RAW264.7表型向M1型極化,。此外,,納米平臺顯著消除免疫抑制的TME,將TAMs表型極化為M1型,,恢復體內(nèi)CD8+T細胞的活性,。此外,它還能顯著激活免疫應(yīng)答,,增強腫瘤組織中免疫促進細胞的浸潤,,誘導腫瘤細胞凋亡,抑制腫瘤細胞的肺轉(zhuǎn)移,。綜上所述,,級聯(lián)響應(yīng)性納米平臺可通過抑制乳酸外流和HCPT來調(diào)節(jié)免疫抑制的TME,,從而增強腫瘤化療免疫治療,。
索萊寶產(chǎn)品亮點

相關(guān)產(chǎn)品
產(chǎn)品名稱 | 產(chǎn)品貨號 |
Anti-SLC16A4 Polyclonal Antibody | K003555P |
Anti-SLC16A3 Polyclonal Antibody | K007834P |
Anti-CD86 Polyclonal Antibody | K000343P |
Anti-CD206 Polyclonal Antibody | K006619P |
Anti-MRC1 Polyclonal Antibody | K009736P |
Anti-BAX Polyclonal Antibody | K106624P |
Anti-BCL2 Polyclonal Antibody | K003505P |
Anti-BCL2 Monoclonal Antibody | K200018M |
Anti-Phospho-BCL2-S70 Polyclonal Antibody | K006243P |
立即詢價
您提交后,,專屬客服將第一時間為您服務(wù)