聯(lián)系電話
- 聯(lián)系人:
- 曹女士
- 電話:
- 400-6111-883
- 手機(jī):
- 售后:
- 4006-111-883
- 傳真:
- 86-21-34615995
- 地址:
- 上海市浦東新區(qū)天雄路166弄1號(hào)3樓
- 網(wǎng)址:
- www.yeasen.com
掃一掃訪問(wèn)手機(jī)商鋪
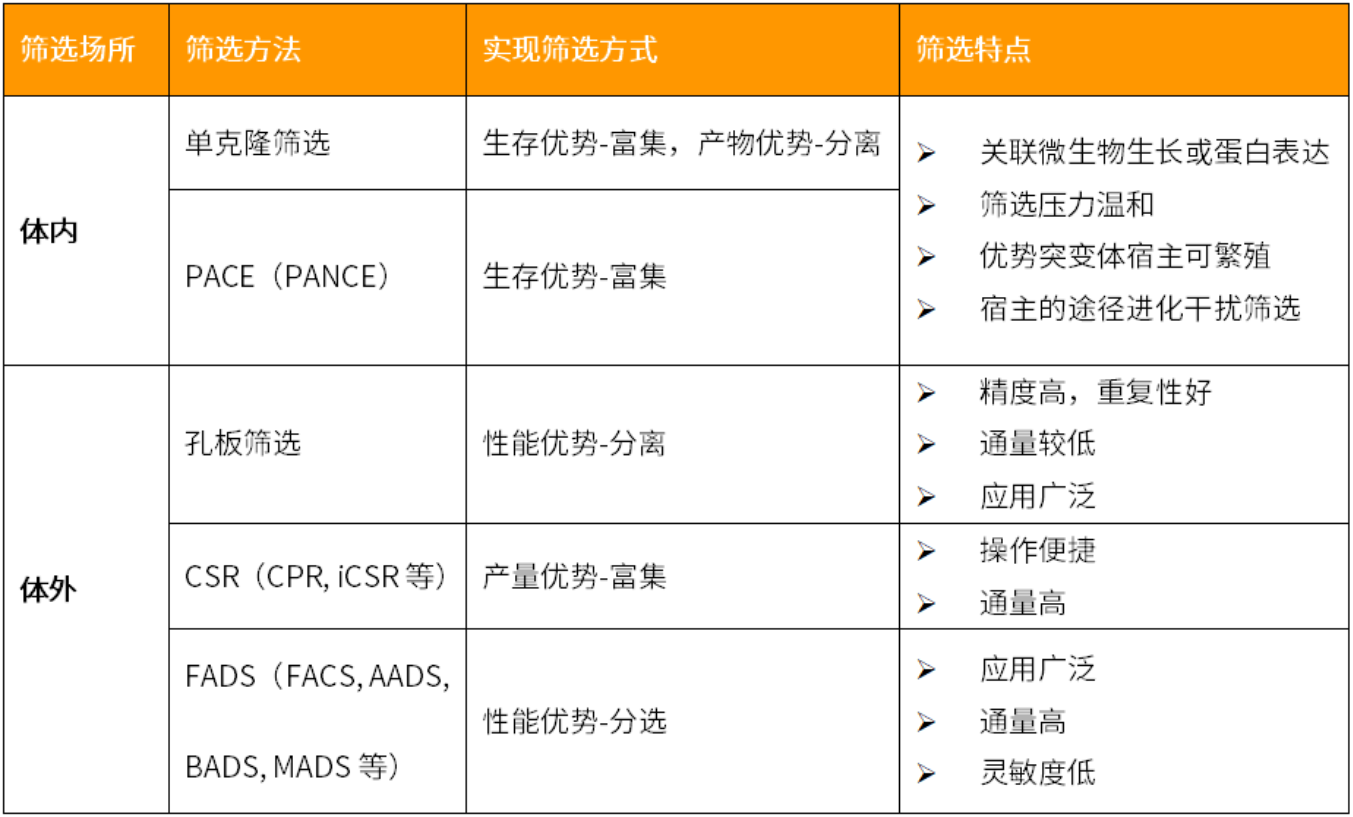
上期,,我們介紹了酶定向進(jìn)化的突變體文庫(kù)構(gòu)建技術(shù)(點(diǎn)擊查看詳情),。高質(zhì)量的突變體文庫(kù)是定向進(jìn)化的基礎(chǔ),,與之相匹配的是高效,、靈敏的突變體篩選技術(shù)手段,。根據(jù)突變體酶參與反應(yīng)的場(chǎng)所來(lái)區(qū)分,篩選技術(shù)可分為體內(nèi)和體外篩選,,篩選的通量和準(zhǔn)確度正隨著技術(shù)的不斷升級(jí)而提升,。
體內(nèi)篩選是由菌株篩選衍生而來(lái),目標(biāo)酶活性與菌株生長(zhǎng),、環(huán)境中底物代謝程度相關(guān),,性能缺陷的酶不足以支撐宿主形成單克隆,或無(wú)法使底物發(fā)生顯著變化,。該方法適用于篩選與細(xì)菌生長(zhǎng),、抗生素耐受等關(guān)鍵代謝途徑相關(guān)的酶,或可使底物發(fā)生顯著顏色變化的蛋白,。不過(guò),,由于微生物可調(diào)整自身代謝流以適應(yīng)環(huán)境,且存在多種補(bǔ)償途徑,,菌株表現(xiàn)的優(yōu)勢(shì)可能并非僅僅是目標(biāo)酶的貢獻(xiàn),。
2011年,David Liu團(tuán)隊(duì)開發(fā)了PACE系統(tǒng)(噬菌體輔助連續(xù)進(jìn)化,,Phage-assisted continuous evolution)用于T7 RNA聚合酶的馴化,。PACE以M13絲狀噬菌體為載體,將目標(biāo)酶的活性與子代噬菌體的數(shù)量相關(guān)聯(lián),。其設(shè)計(jì)原理如圖1b所示,,T7 RNA聚合酶基因取代了噬菌體的衣殼蛋白基因gIII,并受gIII的啟動(dòng)子控制,,gIII基因則安裝在輔助質(zhì)粒上,,受T7啟動(dòng)子控制。重組噬菌體侵染宿主后gIII啟動(dòng)子開放,,T7 RNA聚合酶水平上升,,進(jìn)而介導(dǎo)GIII蛋白大量表達(dá),T7 RNA聚合酶基因被包裝在子代噬菌體內(nèi),。聚合酶活性越高,,產(chǎn)生的活性子代噬菌體顆粒越多,相應(yīng)突變體序列便隨代次增加而逐漸富集,。不僅如此,,PACE系統(tǒng)還包含了誘變質(zhì)粒MP(Mutagenesis plasmid),,多個(gè)誘變基因在L-阿拉伯糖的誘導(dǎo)下,介導(dǎo)包含目的基因在內(nèi)的全基因組范圍的堿基突變,。在連續(xù)流加培養(yǎng)體系中,,基因組上積累了突變的大腸桿菌不斷被新鮮的細(xì)胞稀釋取代,用來(lái)給子代噬菌體提供優(yōu)質(zhì)的宿主,,而攜帶突變的噬菌體持續(xù)侵染并疊加新的突變,,實(shí)現(xiàn)目的基因的連續(xù)篩選和進(jìn)化(圖1a)。利用PACE系統(tǒng),,項(xiàng)目組成功地馴化了可以識(shí)別T3啟動(dòng)子的T7 RNA聚合酶突變體,。

圖1. PACE進(jìn)化系統(tǒng)
(圖片源自:doi: 10.1038/s41596-020-00410-3.)
PACE系統(tǒng)憑借快速、自動(dòng)化的優(yōu)勢(shì)被迅速推廣,,適用于RNA聚合酶,、蛋白酶、tRNA合成酶等酶的進(jìn)化,,以及一些與DNA,、蛋白相互作用的蛋白質(zhì)的篩選(圖1c)。同時(shí),,在GIII的拮抗蛋白GIII-neg的輔助下,,PACE系統(tǒng)可以更靈活地用于提升多種酶的不同性能(圖1d)。盡管如此,,那些無(wú)法關(guān)聯(lián)到gIII或其他噬菌體基因表達(dá)過(guò)程的蛋白依然難以用PACE系統(tǒng)進(jìn)行篩選,,并且所有會(huì)導(dǎo)致大腸桿菌生長(zhǎng)異常的選擇壓力都難以應(yīng)用。
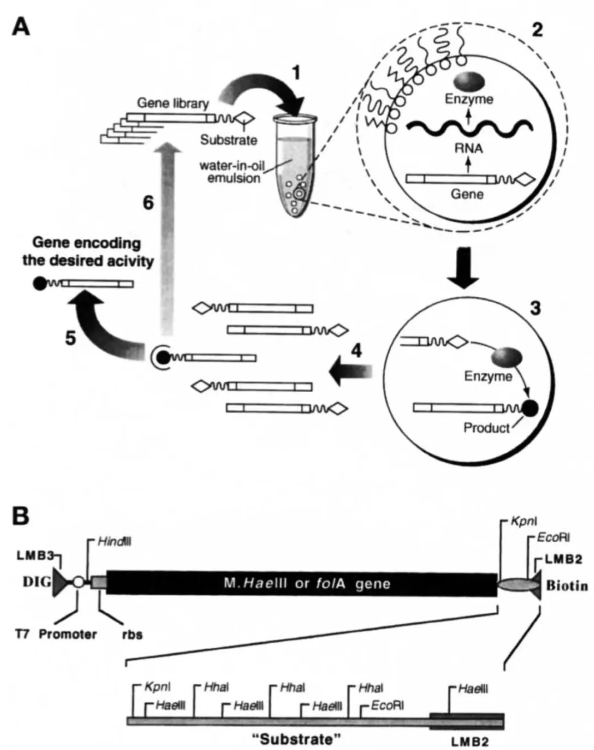
圖2. HaeIII甲基轉(zhuǎn)移酶的篩選
(圖片源自:doi: org/10.1038/nbt0798-652.)
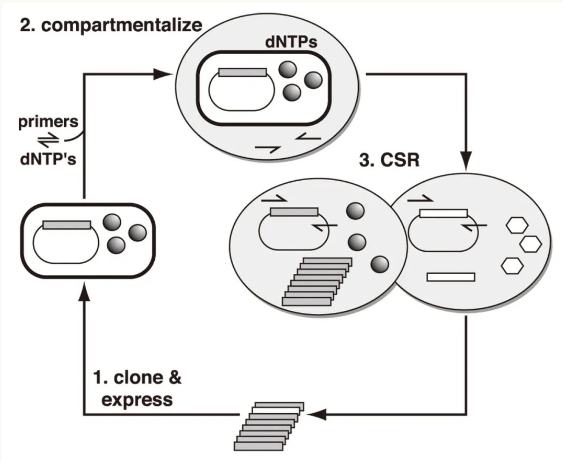
圖3. 分隔自復(fù)制系統(tǒng)
(圖片源自:doi: 10.1073/pnas.071052198.)
以流式分選技術(shù)為例,,只要酶性能與細(xì)胞的大小,、形狀、熒光強(qiáng)度或表面修飾狀態(tài)相關(guān)聯(lián),,當(dāng)細(xì)胞流經(jīng)監(jiān)測(cè)口時(shí)儀器就能采集相關(guān)信號(hào)并借助電荷和磁場(chǎng)的作用,,實(shí)現(xiàn)目標(biāo)細(xì)胞的分選,。而適用于微米級(jí)微生物分選的FADS(Fluorescence-Activated Droplet Sorting)及其衍生系統(tǒng)(AADS、BADS,、MADS)則是另一種技術(shù),,為流式分選和液滴技術(shù)的結(jié)合。微生物細(xì)胞和底物分散在反應(yīng)緩沖液中作為水相流入PDMS芯片中,,油相則從垂直方向進(jìn)入,,通過(guò)調(diào)整兩種液體的流速,水相被均勻地分割為20-50 μm大小的液滴,。不同于耐熱的CSR體系,,液滴分選系統(tǒng)的細(xì)胞破碎只能依賴溶菌酶或其他化學(xué)試劑。為了防止細(xì)胞在進(jìn)入液滴前裂解,,溶菌試劑推薦使用再注入的方法輸入液滴,,或使用替代方案先將溶菌組分與細(xì)胞混合,再將反應(yīng)底物注入液滴,。隨后液滴在合適條件下脫機(jī)孵育,,催化反應(yīng)將使液滴內(nèi)的濁度、pH值,、熒光信號(hào)強(qiáng)度,、特征化合物的量發(fā)生顯著變化,超過(guò)設(shè)定閾值的液滴將在電場(chǎng)或氣流的作用下發(fā)生偏轉(zhuǎn),,流入收集管內(nèi)(圖4),。收集的完整細(xì)胞可直接涂布培養(yǎng),破碎的細(xì)胞則只能擴(kuò)增回收DNA用于后續(xù)實(shí)驗(yàn),。

圖4. 液滴分選
(圖片源自:doi: 10.1016/j.tibs.2021.11.001.)
液滴分選系統(tǒng)具有以下優(yōu)勢(shì):直接檢測(cè)產(chǎn)物,,可準(zhǔn)確反應(yīng)酶學(xué)性能的變化;皮升級(jí)的液滴反應(yīng)器可大幅度節(jié)約試劑成本(~10^6倍),;最多可實(shí)現(xiàn)10^8/day的液滴分選,;可通過(guò)設(shè)計(jì)芯片結(jié)構(gòu)、調(diào)整模塊組合來(lái)適配多種酶的篩選場(chǎng)景,。
針對(duì)以上介紹的不同突變體文庫(kù)篩選方法總結(jié)如下表,,實(shí)際可根據(jù)不同需求選擇。
翌圣ZymeEditor™酶改造定制服務(wù)
翌圣ZymeEditor™是一個(gè)酶改造底層技術(shù)平臺(tái),,該平臺(tái)有四大關(guān)鍵技術(shù):FADS熒光激活微液滴分選技術(shù),,MTPS微孔板篩選技術(shù),、CSR分割自復(fù)制技術(shù)與計(jì)算機(jī)輔助理性設(shè)計(jì)技術(shù),這些酶改造技術(shù)在生物醫(yī)藥,、NGS建庫(kù)、IVD體外檢測(cè)等領(lǐng)域用酶中已得到成功應(yīng)用,。

圖5:ZymeEditor™平臺(tái)四大關(guān)鍵技術(shù)

圖6:ZymeEditor™酶改造定制服務(wù)流程

 初級(jí)會(huì)員·13年
初級(jí)會(huì)員·13年
