前言
以細胞為基礎(chǔ)的治療,包括將細胞作為活性藥物來治療疾病,,近年來在臨床應(yīng)用和醫(yī)藥市場的擴張方面都經(jīng)歷了爆炸性增長,。特別是,一些療法已經(jīng)進入了商業(yè)應(yīng)用,,2017年FDA批準tisagenlecleucel和Axicabatagene ciloleucel分別用于治療急性淋巴細胞白血?。ˋLL)和大B細胞淋巴瘤(LBCL)。近的其他成功包括批準使用患者來源的角膜緣干細胞修復(fù)受損的角膜上皮,,以及使用成人干細胞治療與克羅恩病相關(guān)的瘺管,。目前,臨床試驗數(shù)量不斷擴大,,商業(yè)上批準的治療方法也越來越多,。
然而,盡管近取得了顯著的臨床和商業(yè)成功,,但基于細胞的療法仍然面臨著許多挑戰(zhàn),,限制其廣泛轉(zhuǎn)化和商業(yè)化。這些挑戰(zhàn)包括確定適當(dāng)?shù)募毎麃碓?,生產(chǎn)出足夠可行,、有效和安全的產(chǎn)品,以滿足患者和疾病的特定需求,,以及可擴展制造流程的開發(fā),。面對這些障礙,科學(xué)家們正在通過使用由新一代工程學(xué)方法,,包括基因組和表觀基因組編輯,、合成生物學(xué)以及生物材料的應(yīng)用,以驅(qū)動基礎(chǔ)研究加以解決,。
細胞療法的優(yōu)勢和挑戰(zhàn)
人們對于細胞治療的持續(xù)熱情很大程度上源于重新賦予固有細胞功能的前景,,以實現(xiàn)超越其他治療模式的安全性和有效性。相比而言,,盡管生物制劑(包括重組蛋白和其他細胞衍生生物分子)可以利用大分子的識別能力來實現(xiàn)高度的靶向特異性,,但它們?nèi)菀桩a(chǎn)生不利的藥代動力學(xué)(PK)和藥效學(xué)(PD)特性,從而限制其安全性和有效性,。
細胞療法具有*的內(nèi)在特征,,有可能提高對疾病的療效。例如,,細胞可以在特定組織或器官中自然遷移、定位甚至增殖,。此外,,細胞可以主動感知來自小分子、細胞表面標(biāo)記蛋白甚至物理力的各種外部信息。因此,,基于細胞的療法具有高度復(fù)雜的感知和反應(yīng)功能,,可以通過檢測相關(guān)的分子線索和提供包括激活內(nèi)在反應(yīng)或治療性轉(zhuǎn)基因表達在內(nèi)的多因素輸出反應(yīng)來動態(tài)跟蹤疾病狀態(tài)。,,由于細胞能夠在體內(nèi)存活,、消耗營養(yǎng)物質(zhì)并通過分泌因子的產(chǎn)生影響其外部環(huán)境,因此基于細胞的治療可用于維持的內(nèi)源性藥物輸送,。
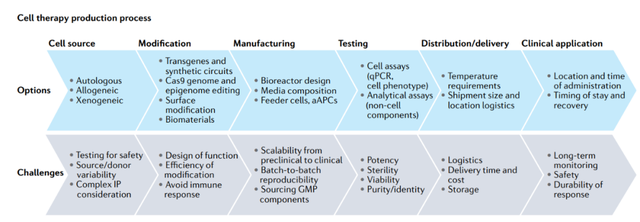
盡管針對各種適應(yīng)癥的細胞治療正在取得進展,,但開發(fā)新產(chǎn)品仍然是一項艱巨的任務(wù),因為針對特定疾病的治療策略必須克服一系列重大挑戰(zhàn),,才能成功生產(chǎn)出具有臨床和商業(yè)可行性的產(chǎn)品,。
這些挑戰(zhàn)包括:
需要確定細胞來源,以產(chǎn)生具有穩(wěn)健和穩(wěn)定特性的產(chǎn)品,,并且出于工程目的,,易于進行基因操作。
基于細胞的產(chǎn)品需要具有足夠的活力,,以確保足夠的治療作用持續(xù)時間,。
必須通過改變現(xiàn)有的細胞特性或設(shè)計新的特性來實現(xiàn)可預(yù)測和確定的治療效力水平。
細胞的PK/PD特性必須與疾病的特定生理需要相匹配,。
必須確保細胞治療產(chǎn)品的安全性和致瘤性,,以限制宿主免疫系統(tǒng)的不良反應(yīng)并防止腫瘤形成。
必須開發(fā)可擴展的制造工藝,,以高效且經(jīng)濟的方式生產(chǎn)出足夠數(shù)量的細胞,,供給藥患者使用。
細胞治療的過去與現(xiàn)在
以細胞為基礎(chǔ)的人類療法早開始于20世紀50年代的骨髓移植形式,,用于血源性癌癥患者,。這些治療的成功,是細胞治療疾病潛力的證據(jù),,為近幾十年來以臍帶血來源的HSC和造血祖細胞(HPC)為來源的治療批準鋪平了道路,。這些產(chǎn)品在臨床上廣泛使用,包括迄今為止FDA批準的多種基于細胞的療法,。
但是,,這些治療方法在商業(yè)化轉(zhuǎn)化方面遇到了巨大障礙,包括確定易于采購和制造的細胞來源,,以及解決它們與宿主免疫系統(tǒng)的相互作用,。這些挑戰(zhàn)對安全性和有效性構(gòu)成了持久的障礙,導(dǎo)致在過去十年之前,,只有少數(shù)基于細胞的新療法獲得批準進入市場,。
個突破性的非HPC產(chǎn)品是前列腺癌治療,從患者身上分離的樹突狀細胞在體外暴露于重組腫瘤抗原,然后重新引入以促進T細胞介導(dǎo)的抗腫瘤反應(yīng),。這種sipuleucel-T療法在2010年獲得FDA批準時被吹捧為“個性化”癌癥療法,,但由于療效不一致和報銷不確定,使其使用受到限制,,這是制造過程的高成本和技術(shù)復(fù)雜性導(dǎo)致的后果,。其他早期進入市場的藥物包括使用患者和供體來源的成纖維細胞局部治療組織損傷,以及使用患者來源的軟骨細胞修復(fù)關(guān)節(jié)軟骨,。
在FDA對個CAR-T療法的監(jiān)管批準后,,過去十年中,細胞療法的商業(yè)化進展顯著加快,。目前,,已有5個針對難治性多發(fā)性骨髓瘤,以及ALL和LBCL的的CAR-T產(chǎn)品獲批,。更多的使用各種效應(yīng)細胞,,例如NK細胞,正在進行多種固體和血液腫瘤的臨床試驗,,其中一些報告了突破性的成功,。
除了癌癥療法繼續(xù)獲得多的關(guān)注,幾個新興領(lǐng)域的臨床成功也引起了人們的興趣,。這些包括自身免疫疾病,、中樞神經(jīng)系統(tǒng)(CNS)和神經(jīng)退行性疾病、心血管疾病和各種孤兒病的治療,。其中一些療法是利用間充質(zhì)干細胞(MSCs)開發(fā)的,,治療克羅恩病相關(guān)瘺管的darvadstrocel,是少數(shù)商業(yè)化MSC產(chǎn)品之一,。另一種的產(chǎn)品是remestemcel-L,,它使用供體來源的、培養(yǎng)擴增的骨髓間充質(zhì)干細胞治療GvHD,。
目前,,越來越多的療法正在通過臨床試驗取得進展,這些療法使用來自多能干細胞的細胞產(chǎn)品,。來自誘導(dǎo)多能干細胞(IPSC)的視網(wǎng)膜色素上皮細胞被用于治療急性黃斑變性和Stargardt病,。中樞神經(jīng)系統(tǒng)疾病是此類療法的另一個活躍領(lǐng)域,有幾個研究正在使用IPSC生成多巴胺能神經(jīng)元以用于帕金森病,,還有一些基于干細胞的方法正在進行中風(fēng),、癲癇、脊髓損傷,、阿爾茨海默病,、多發(fā)性硬化和疼痛的臨床前研究,。
細胞工程學(xué)創(chuàng)新
目前,人們正在探索細胞工程學(xué)科的創(chuàng)新,,包括基因組和表觀基因組編輯、合成生物學(xué)以及生物材料,,以應(yīng)對細胞治療的重大挑戰(zhàn),。其中一些方法已成功用于生產(chǎn)商業(yè)化產(chǎn)品,但許多方法仍處于臨床前階段,。
基因組和表觀基因組編輯
CRISPR/CAS9作為可編程工具在活細胞中設(shè)計人類基因組和表觀基因組,,推動了細胞治療學(xué)的進展。Cas9介導(dǎo)的非同源末端連接(NHEJ)已被用于沉默致病位點,、去除有害插入物和賦予對病毒的抗性,。
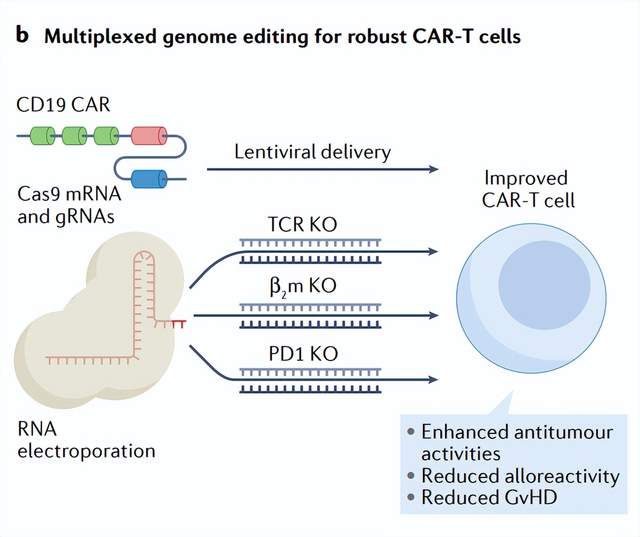
除了Cas9介導(dǎo)的NHEJ靶向單個基因座,同時靶向多個基因座的復(fù)合方法近年來也取得了實質(zhì)性進展,。例如,,利用同時靶向T細胞受體(TCR)、β2-微球蛋白(β2m)和PD-1基因的Cas9 mRNA和gRNAs進行基于CRISPR–Cas9的多重基因組編輯,,已與慢病毒載體CAR結(jié)合使用,,以生成缺乏TCR、HLA I類分子和PD1的異基因CAR-T細胞,,這為通用CAR-T細胞的研究打開了大門,。重要的是,這些類型的組合策略對于解決細胞治療面臨的一些重大挑戰(zhàn)至關(guān)重要,,尤其是通過降低自體細胞源的免疫原性和增強工程細胞的活性,,從而提高患者的安全性和治療效力。
除了正在進行的臨床試驗和創(chuàng)建新的CAR平臺之外,,基因組編輯在開發(fā)用于治療的“現(xiàn)成”工程細胞方面也發(fā)揮了重要作用,。例如,經(jīng)過編輯以去除CD7和TRAC的人類T細胞顯示出對抗T細胞急性淋巴細胞白血?。═-ALL)的效力,,而沒有異種GvHD的證據(jù)。在細胞分化之前進行基因組編輯是另一種選擇,,例如,,破壞IPSC中的HLA基因已被證明是增強免疫兼容性的有效方法,敲除B2M并同時過表達CD47的類似策略也產(chǎn)生了免疫原性顯著降低的IPSC ,。
基于人類iPSC的現(xiàn)成療法正在取得快速進展,,實體瘤和晚期血液惡性腫瘤的臨床試驗正在進行中(NCT03841110和NCT04023071)。在臨床環(huán)境中使用基因組編輯的這些令人興奮的進展已擴展到許多嚴重適應(yīng)癥,,包括細菌感染(NCT04191148),、β-地中海貧血和鐮狀細胞?。∟CT03655678;EDIT-301),、B型血友?。∟CT02695160)和II型粘多糖病II(NCT03041324)。
此外,,基于CRISPR/CAS9的表觀基因組編輯工具已用于模擬基因表達和表觀基因組失調(diào)的幾種人類疾病和疾病治療,。近值得注意的例子包括神經(jīng)肌肉組織和酶紊亂,以及腎病和糖尿病,。隨著這些編程人類基因表達和人類表觀基因組的新技術(shù)不斷涌現(xiàn)和成熟,,當(dāng)?shù)幕诩毎寞煼ê统R?guī)基因組編輯相結(jié)合時,它們無疑將成為下一代細胞藥物的組成部分,。
合成生物學(xué)
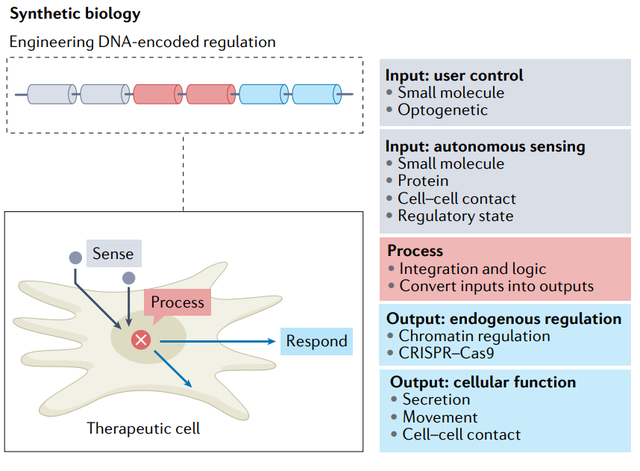
過去二十年來,,合成生物學(xué)領(lǐng)域不斷涌現(xiàn),其目標(biāo)是通過應(yīng)用定量設(shè)計規(guī)則,,使基因工程結(jié)果更加,、可預(yù)測和可重復(fù)。盡管它在微生物系統(tǒng)方面取得了早的突破,,但近年來該領(lǐng)域在人類細胞工程方面也取得了重大進展,。通過控制治療性轉(zhuǎn)基因表達或分泌治療因子的傳遞,或通過編程細胞來感知與特定組織或疾病狀態(tài)相關(guān)的生物分子,,并通過改變細胞行為作出反應(yīng),,可以增強基于細胞的治療。
近利用合成生物學(xué)解決過繼性T細胞治療中的特異性和活性的成功證明了這一系列方法,。在這一領(lǐng)域成功的應(yīng)用之一是一種蛋白質(zhì)安全殺傷開關(guān),,該開關(guān)被設(shè)計用于引起植入細胞的凋亡。該開關(guān)的嵌合設(shè)計以人caspase9與修飾的人FK結(jié)合域融合為特征,,能夠在施用小分子藥物AP1903后二聚并激活凋亡信號,。雖然初開發(fā)該開關(guān)是為了在干細胞移植過程中消除同種異體反應(yīng)性T細胞,但隨后其被用于CAR-T治療的臨床試驗,,以限制CRS中效應(yīng)器的增殖(NCT03696784),。
CAR-T合成生物學(xué)近的一個重要焦點是制定策略以增強腫瘤靶向特異性。一個例子是受體介導(dǎo)的基因調(diào)節(jié)回路設(shè)計,,其中融合單鏈抗體的工程化嵌合Notch受體在與相鄰細胞表面的配體結(jié)合時被觸發(fā),,導(dǎo)致轉(zhuǎn)錄激活劑的蛋白水解釋放和轉(zhuǎn)基因表達。該系統(tǒng)初被設(shè)計為在第二個配體存在下表達CAR,,從而實現(xiàn)抗原結(jié)合的雙特異性識別,。synNotch的進一步發(fā)展,有可能區(qū)分特定腫瘤和旁觀者組織,。
合成生物學(xué)的另一個主要重點是開發(fā)閉環(huán)調(diào)節(jié)回路,,用于監(jiān)測生理或疾病狀態(tài)特征,,并對治療結(jié)果作出反應(yīng)。利用轉(zhuǎn)基因報告來改變天然信號轉(zhuǎn)導(dǎo)途徑的策略已經(jīng)得到利用,。一個例子是兩階段細胞因子轉(zhuǎn)換回路,,該回路在階段將TNF-α依賴性NF-κB信號轉(zhuǎn)換為IL-22生成,然后激活細胞因子受體并通過STAT3發(fā)出信號,,驅(qū)動抗炎細胞因子IL-10和IL-4的轉(zhuǎn)錄生成和分泌,。在小鼠體內(nèi)試驗中,含有該回路的細胞可以減輕小鼠銀屑病模型中的炎癥,。類似地,人們構(gòu)建了β-細胞模擬細胞,,該細胞引入一個回路,,通過將糖酵解介導(dǎo)的鈣離子進入與驅(qū)動胰島素表達和分泌的轉(zhuǎn)錄回路的誘導(dǎo)相聯(lián)系來感知葡萄糖。當(dāng)植入糖尿病小鼠模型時,,工程細胞以葡萄糖反應(yīng)的方式分泌胰島素,,從而糾正胰島素缺乏,并降低高血糖,。
生物材料
半透性生物材料和水凝膠已用于改善治療細胞的傳遞,、活性、保留和安全性,。從可降解水凝膠到不可降解塑料和金屬等,,人們探索了一系列生物材料,以改善輸送和活性,,促進細胞在特定體腔內(nèi)的保留,,促進控釋,并實現(xiàn)可回收性以提高安全性,。
細胞治療中同種異體細胞的排斥反應(yīng),,限制了現(xiàn)成的細胞治療產(chǎn)品的開發(fā)。然而,,介導(dǎo)同種異體細胞排斥反應(yīng)的免疫機制需要細胞-細胞接觸,。目前,人們在積極探索一種策略,,即在半多孔膜中使用同種異體細胞的細胞封裝來實現(xiàn)免疫隔離,。這些努力的目標(biāo)是將移植細胞從患者自身的免疫系統(tǒng)中隔離,同時允許可溶性因子的雙向運輸,,葡萄糖和氧氣等營養(yǎng)物質(zhì)的流入,,以支持移植細胞的存活,以及產(chǎn)生的治療性蛋白質(zhì)的輸出,。通過使用海藻酸鈉水凝膠促進大鼠胰島的免疫隔離,,證明了在動物中的可行性,。這項研究表明,短期(數(shù)周)移植的同種異體細胞在免疫活性動物中具有功能,。近年來,,許多膠囊化細胞產(chǎn)品已在臨床上進行了廣泛的細胞治療應(yīng)用評估,包括眼科學(xué),、內(nèi)分泌學(xué),、腫瘤學(xué)。
小結(jié)
縱觀細胞治療研究的進展,,很明顯,,基因組和表觀基因組編輯、合成生物學(xué)以及生物材料介導(dǎo)的免疫調(diào)節(jié),,將在創(chuàng)建新細胞治療產(chǎn)品管線方面發(fā)揮越來越大的作用,,從而提高患者的安全性、有效性和可及性,。近的科學(xué)不僅證明了這些領(lǐng)域開發(fā)的技術(shù)的潛在影響,,而且還確定了克服目前限制細胞療法更廣泛商業(yè)化的重大挑戰(zhàn)的潛在途徑。因此,,技術(shù)創(chuàng)新是未來影響細胞治療產(chǎn)品的關(guān)鍵,,這些創(chuàng)新使得更容易采購和制造的同種異體產(chǎn)品具有更大的效力和生存能力。
文章來源:小藥說藥
相關(guān)產(chǎn)品
免責(zé)聲明
- 凡本網(wǎng)注明“來源:化工儀器網(wǎng)”的所有作品,,均為浙江興旺寶明通網(wǎng)絡(luò)有限公司-化工儀器網(wǎng)合法擁有版權(quán)或有權(quán)使用的作品,,未經(jīng)本網(wǎng)授權(quán)不得轉(zhuǎn)載、摘編或利用其它方式使用上述作品,。已經(jīng)本網(wǎng)授權(quán)使用作品的,,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:化工儀器網(wǎng)”,。違反上述聲明者,,本網(wǎng)將追究其相關(guān)法律責(zé)任。
- 本網(wǎng)轉(zhuǎn)載并注明自其他來源(非化工儀器網(wǎng))的作品,,目的在于傳遞更多信息,,并不代表本網(wǎng)贊同其觀點和對其真實性負責(zé),不承擔(dān)此類作品侵權(quán)行為的直接責(zé)任及連帶責(zé)任,。其他媒體,、網(wǎng)站或個人從本網(wǎng)轉(zhuǎn)載時,必須保留本網(wǎng)注明的作品第一來源,,并自負版權(quán)等法律責(zé)任,。
- 如涉及作品內(nèi)容、版權(quán)等問題,,請在作品發(fā)表之日起一周內(nèi)與本網(wǎng)聯(lián)系,,否則視為放棄相關(guān)權(quán)利,。
 手機版
手機版 化工儀器網(wǎng)手機版
化工儀器網(wǎng)手機版
 化工儀器網(wǎng)小程序
化工儀器網(wǎng)小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關(guān)注視頻號
掃碼關(guān)注視頻號




















 采購中心
采購中心