
RNA修飾在生命過程和疾病發(fā)生發(fā)展中的作用逐漸受到重視,,其中5-甲基胞嘧啶(m5C)修飾是熱門研究領域。
本文聚焦于m5C 甲基轉移酶NSUN2在肝癌中的作用,,NSUN2通過M5C修飾穩(wěn)定PKM2 mRNA促進肝癌糖酵解和進展,。
m5C修飾是指在RNA分子中,,通過特定的酶將胞嘧啶(C)的第5位碳原子上加上一個甲基基團,,形成5-甲基胞嘧啶,。
這種修飾不會改變RNA的基本核苷酸序列,但會在不改變遺傳信息編碼的基礎上,,賦予RNA新的化學和生物學特性,。
m5C修飾主要由NSUN(NOL1/NOP2/SUN)家族的甲基轉移酶催化完成,涉及mRNA穩(wěn)定性與翻譯調控,、tRNA 穩(wěn)定性與解碼功能、
rRNA加工與核糖體功能和非編碼RNA功能調節(jié),,廣泛地參與到各種生命活動的調控中,。
研究背景:
肝癌(HCC)是常見癌癥及癌癥死亡主要原因,術后轉移復發(fā)致患者5年生存率低,。RNA 的5-甲基胞嘧啶(m5C)修飾
在多種癌癥中發(fā)揮作用,,NSUN2是m5C甲基轉移酶,但它在肝癌中的臨床意義,、作用機制等尚不明確,。
研究方法:
臨床樣本采集與分組:收集125對肝癌(HCC)及相應癌旁組織(ANL),用于RT-qPCR,、western blot及IHC分析NSUN2
表達分布與患者臨床特征的相關性,,并進行mRNA m5C斑點印跡和m5C-RIP-seq測序。
細胞實驗:主要檢測多株肝癌細胞株的及增殖,、遷移和侵襲等細胞行為學改變,。
動物實驗:選用5周齡雄性BALB/c裸鼠,在其雙側腋窩皮下接種HCC細胞建立皮下異種移植模型,,定期測量腫瘤體積,;
通過尾靜脈注射HCC細胞建立肺轉移模型,用活體成像系統(tǒng)監(jiān)測轉移過程,。
其他:RNA免疫沉淀實驗,、熒光素酶報告基因實驗、放線菌素D實驗,、代謝測量實驗等,;
主要研究結果:
(1)NSUN2在HCC組織中的表達上調;
通過對125對HCC和癌旁組織(ANL)的研究,,運用蛋白質免疫印跡(WB)和免疫組化(IHC)分析,,結果顯示HCC組織
中NSUN2的蛋白水平顯著高于ANL組織,。Kaplan-Meier 生存分析,結果顯示NSUN2高表達患者的總生存期(OS)和
無復發(fā)生存期(RFS)明顯低于NSUN2低表達患者,。此外,,對80例HCC患者的臨床病理特征與NSUN2表達進行分析,
發(fā)現NSUN2高表達與腫瘤大小,、微血管侵犯(MVI),、TNM分期和BCLC分期顯著相關。腫瘤越大,、存在微血管侵犯,、
TNM分期和BCLC分期越晚,NSUN2的表達越高,。

圖1. HCC組織中NSUN2高表達并與HCC不良預后有關,。
(2)體內外實驗檢測NSUN2 對HCC生長和轉移的影響
運用慢病毒分別在HepG2和SNU387細胞中穩(wěn)定過表達NSUN2,在Hep3B和Huh7細胞中穩(wěn)定沉默NSUN2,。
過表達NSUN2能夠促進肝癌細胞增殖和遷移,,而沉默NSUN2則抑制肝癌細胞增殖和遷移。體內實驗結果表明,,
NSUN2過表達顯著促進了裸鼠皮下瘤生長并增加肝癌肺轉移,,而NSUN2沉默則抑制皮下瘤生長和肺轉移。

圖2. NSUN2在體內外誘導肝癌的生長和轉移,。
(3)NSUN2介導的m5C修飾在肝癌HCC中的作用
對5對HCC和癌旁正常肝組織進行m5C dot blotting,,結果顯示HCC組織中總mRNA m5C 水平高于ANL組織;
m5C-RIP-seq分析顯示HCC和癌旁正常肝組織m5C修飾存在差異,,聯合分析mRNA m5C-RIP-seq和 mRNA-Seq數據,,
發(fā)現HCC中mRNA表達與m5C水平呈輕度正相關;KEGG通路分析顯示,,表達和m5C水平均上調的mRNA主要富集在
10條信號通路中,,其中癌癥中的中心碳代謝、半乳糖代謝,、果糖和甘露糖
代謝等與代謝相關,。

圖3. NSUN2介導的m5C高甲基化促進肝細胞癌的代謝轉變。
(4)PKM2是NSUN2介導的m5C修飾的主要靶標
對Hep3B-NSUN2-sh2細胞及其陰性對照進行mRNA測序,,結果顯示敲低NSUN2后,,236個基因上調,376個基因下調,。
將HCC中表達上調的mRNA,、m5C 水平上調的mRNA以及 Hep3B細胞中敲低NSUN2后表達下調的mRNA進行重疊分析,
通過維恩圖篩選出11個符合標準的mRNA(B3GNT3,、CD7,、EML2,、FOXC1、GDF15,、LRP4,、MAPT、MCTP1,、PKM2,、
PODXL 和 SLC1A7)。檢測這11個mRNA在40對HCC和癌旁正常肝組織中的表達,,發(fā)現其中7個在HCC中上調,。
進一步檢測這7個mRNA在肝癌細胞系中的表達,結果顯示,,在HepG2和SNU387細胞中過表達NSUN2后,,只有PKM2的表達上調;
在Hep3B 和Huh7細胞中沉默NSUN2后,,PKM2的表達下調,。此外,根據m5C-RIP-seq結果,,
PKM2 mRNA上調的m5C峰位于其3′ - UTR(chr15:72491753 - 72491855,hg19),。通過針對該峰的m5C-RIP-qPCR驗證了這一結果,,
進一步表明PKM2 mRNA是NSUN2作用的主要靶標。

圖4. PKM2 mRNA是NSUN2作用的靶標,。
(5)NSUN2通過增加m5C水平穩(wěn)定PKM2 mRNA
通過放線菌素D處理HCC細胞,,并在不同時間點利用RT-qPCR分析PKM2 mRNA水平。結果顯示,,過表達NSUN2會減緩
PKM2 mRNA的降解,,而沉默NSUN2則加速其降解。m5C-RIP-qPCR發(fā)現SNU387細胞中過表達NSUN2后,,PKM2 mRNA m5C
水平升高,;在 Hep3B細胞中沉默NSUN2后,其m5C水平降低,;隨后,,使用針對PKM2的m5C峰的引物和經亞硫酸氫鹽轉化
RNA逆轉錄的cDNA模板進行亞硫酸氫鹽PCR,然后進行Sanger測序,,發(fā)現在chr15:72491773(hg19)位點(C773)的信號中,,
既有胞嘧啶(‘C’)又有胸腺嘧啶(‘T’),這表明該位點在HCC組織和細胞系中均發(fā)生了m5C 甲基化,。通過計算各樣本中
C773位點的m5C水平,,發(fā)現HCC組織中的m5C水平高于癌旁正常肝組織,。同時,SNU387細胞過表達 NSUN2后該位點m5C水平上升,,
Hep3B細胞沉默NSUN2后該位點m5C水平則下降,。最后,構建含有野生型3′-UTR的PKM2 mRNA(PKM2-WT)和突變型 C773
(PKM2-Mut)的質粒進行熒光素酶報告基因實驗,。結果表明,,過表達NSUN2可增加 PKM2-WT的熒光素酶活性,對PKM2-Mut
則無此作用,;沉默NSUN2的效果則相反表明 NSUN2 對PKM2的調控作用依賴于m5C位點C773,。

圖5. NSUN2通過增加m5C水平穩(wěn)定PKM2 mRNA。
(6)NSUN2通過上調PKM2促進HCC的糖酵解和進展
通過檢測過表達和敲低NSUN2后HCC細胞的葡萄糖攝取,、乳酸生成,、細胞外酸化率(ECAR)和糖酵解質子外流率(glycoPER)
來評估糖代謝變化。發(fā)現過表達NSUN2顯著增加了葡萄糖攝取,、乳酸生成,、ECAR和glycoPER,敲低NSUN2則降低了這些指標,,
表明 NSUN2 促進HCC細胞的糖酵解,。
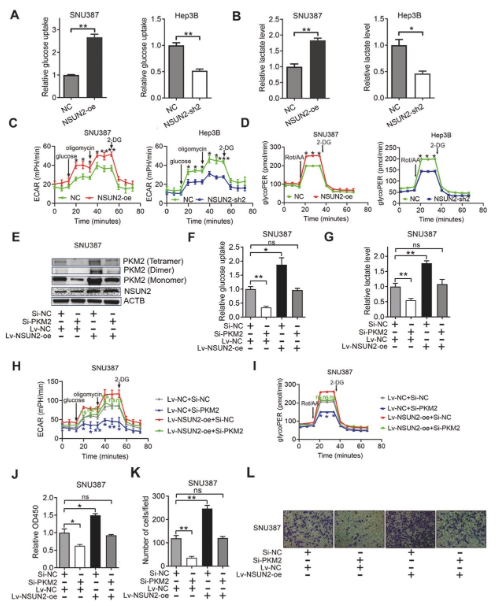
圖6. NSUN2通過上調PKM2促進HCC的糖酵解和進展。
隨后,,使用siRNA靶向PKM2,,發(fā)現其可下調PKM2四聚體、二聚體和單體的表達,,而過表達NSUN2可減緩這種下調作用,。
敲低PKM2抑制了葡萄糖攝取、乳酸生成,、ECAR和glycoPER,,而過表達NSUN2可部分阻斷這些抑制作用,表明NSUN2 對
HCC糖酵解的促進作用部分通過上調PKM2實現,。最后,,檢測了PKM2對HCC細胞生長和侵襲的影響及NSUN2的作用,發(fā)現
敲低PKM2抑制了HCC細胞的生長和侵襲,,而過表達NSUN2可阻斷這種抑制作用,,說明NSUN2通過上調PKM2促進HCC細胞
的生長和侵襲。
(7)研究示意圖
直觀地展示從NSUN2表達上調,,到PKM2 mRNA穩(wěn)定,、PKM2蛋白增加,再到促進HCC糖酵解,、細胞增殖和遷移的一系列過程,,
為理解HCC的發(fā)病機制提供了重要的理論依據,,也為后續(xù)研究潛在的治療靶點提供了方向。

圖7. NSUN2介導PKM2在HCC中的m5C調節(jié)機制示意圖,。
研究總結:
肝癌中NSUN2表達上調且與預后不良相關,;NSUN2通過增加PKM2 mRNA的m5C修飾穩(wěn)定其表達,促進糖酵解,,進而推動肝癌進展,,
研究shou次明確PKM2是NSUN2介導m5C修飾的靶基因,揭示NSUN2促進肝癌進展的關鍵機制,。綜合多種實驗方法,,從細胞、
動物模型及臨床樣本quan方位驗證,,NSUN2可作肝癌預后指標和治療靶點,,為肝癌臨床診療提供新思路。
參考文獻
Qi, Q., Zhong, R., Huang, Y. et al. The RNA M5C methyltransferase NSUN2 promotes progression of hepatocellular
carcinoma by enhancing PKM2-mediated glycolysis. Cell Death Dis 16, 82 (2025).