各位讀者好,今天為大家?guī)硪黄褂?span style=";padding: 0px;color: red">整合轉錄組學,、蛋白質(zhì)組學,、生物信息學和分子對接策略來研究pochonin D(PoD)在三陰性乳腺癌(TNBC)中的作用、潛在靶點和機制的高分文章,,是由中國藥科大學團隊2025年2月在ACS Cent Sci發(fā)表的,,
題為“Discovery of Natural Resorcylic Acid Lactones as Novel Potent Copper Ionophores Covalently Targeting PRDX1 to Induce Cuproptosis
for Triple-Negative Breast Cancer Therapy"。從中藥內(nèi)生真菌中分離出天然產(chǎn)物,,誘導三陰性乳腺癌(TNBC)細胞發(fā)生銅死亡,,為TNBC的
治療提供了新的理論依據(jù),,也為TNBC的臨床治療藥物提供了可能,。
三陰性乳腺癌(TNBC)是一種侵襲性強的乳腺癌亞型,缺乏雌激素受體(ER),、孕激素受體(PR)和人表皮生長因子受體2(HER2)表達,,
導致分子靶向療法通常無效,患者預后差,,急需新的治療靶點和有效藥物,。銅死亡是2022年新發(fā)現(xiàn)的細胞死亡形式,由銅與三羧酸循環(huán)的
脂?;煞种苯咏Y合觸發(fā),,在癌癥治療中具有潛在應用價值。銅離子載體在銅死亡的發(fā)現(xiàn)和應用中發(fā)揮了重要作用,,可能成為抗腫瘤藥物,。
天然產(chǎn)物結構多樣、生物活性高,、毒性低,,約50%的抗癌藥物直接或間接來源于天然產(chǎn)物。間苯二酸內(nèi)酯(RALs)是一類真菌來源的聚酮
化合物,,具有多種生物活性,,可能成為治療TNBC的潛在藥物。
本研究從植物內(nèi)生真菌llyonectria sp.中分離出24個間苯二酸內(nèi)酯(RALs),其中9個為新化合物,。研究發(fā)現(xiàn)Pochonin D(PoD)能有效抑制
三陰性乳腺癌(TNBC)細胞增殖,。通過多種技術確定PRDX1是PoD的直接靶點,PoD通過與PRDX1的Cys173位點共價結合,,抑制其酶活性,,
誘導細胞內(nèi)銅積累,觸發(fā)銅死亡,,發(fā)揮抗TNBC活性,。此外,PRDX1高表達與TNBC患者預后不良相關,,PRDX1抑制劑可能是潛在的銅離子載體,,
為TNBC治療提供了新策略。
研究框架:
1. 提出問題
TNBC是侵襲性強的乳腺癌亞型,,缺乏有效治療靶點,,而銅死亡是新型細胞死亡形式,因此識別誘導TNBC銅死亡的藥物靶點和銅離子
載體是臨床急需解決的問題,。
2. 研究框架
從植物內(nèi)生真菌中分離化合物,,評估其對TNBC細胞的活性,確定有效化合物,,再深入研究其作用機制和靶點,。
3. 研究方法
化合物分離鑒定:采用代謝組學和抗腫瘤活性導向分離法,從內(nèi)生真菌中分離24個間苯二酸內(nèi)酯(RALs),,用多種光譜技術確定結構,。
活性評估:用細胞毒性實驗、克隆形成實驗,、細胞周期和凋亡實驗等評估化合物活性,。
機制研究:用轉錄組學、蛋白質(zhì)組學,、生物信息學分析,、CMap、OTTER等技術,,結合臨床樣本,,研究化合物作用機制和靶點。
4. 分析數(shù)據(jù)
對實驗數(shù)據(jù)進行統(tǒng)計分析,,如比較不同處理組細胞活性,、基因表達差異等,確定化合物活性和作用機制,。
5. 得出結論
發(fā)現(xiàn)Pochonin D(PoD)能有效抑制TNBC細胞增殖,,通過結合PRDX1抑制其酶活性,,干預銅死亡發(fā)揮抗癌作用,表明PRDX1是與
銅死亡相關的生物標志物和治療靶點,,PoD是新型銅離子載體,。


研究流程示意圖
結果解析:
1. RALs的分離與結構鑒定
從植物內(nèi)生真菌Ilyonectria sp. FL - 710中分離出24個RALs,包括9個新化合物,。通過多種光譜分析,、NMR和ECD計算以及X射線晶體學
確定了它們的結構和構型。如ilyolactone A,,根據(jù)HRESIMS,、NMR等數(shù)據(jù)確定其分子式為C19H23ClO8,并通過X射線衍射確定其絕對
構型,。 
2. Pochonin D(PoD)對TNBC細胞的抑制作用
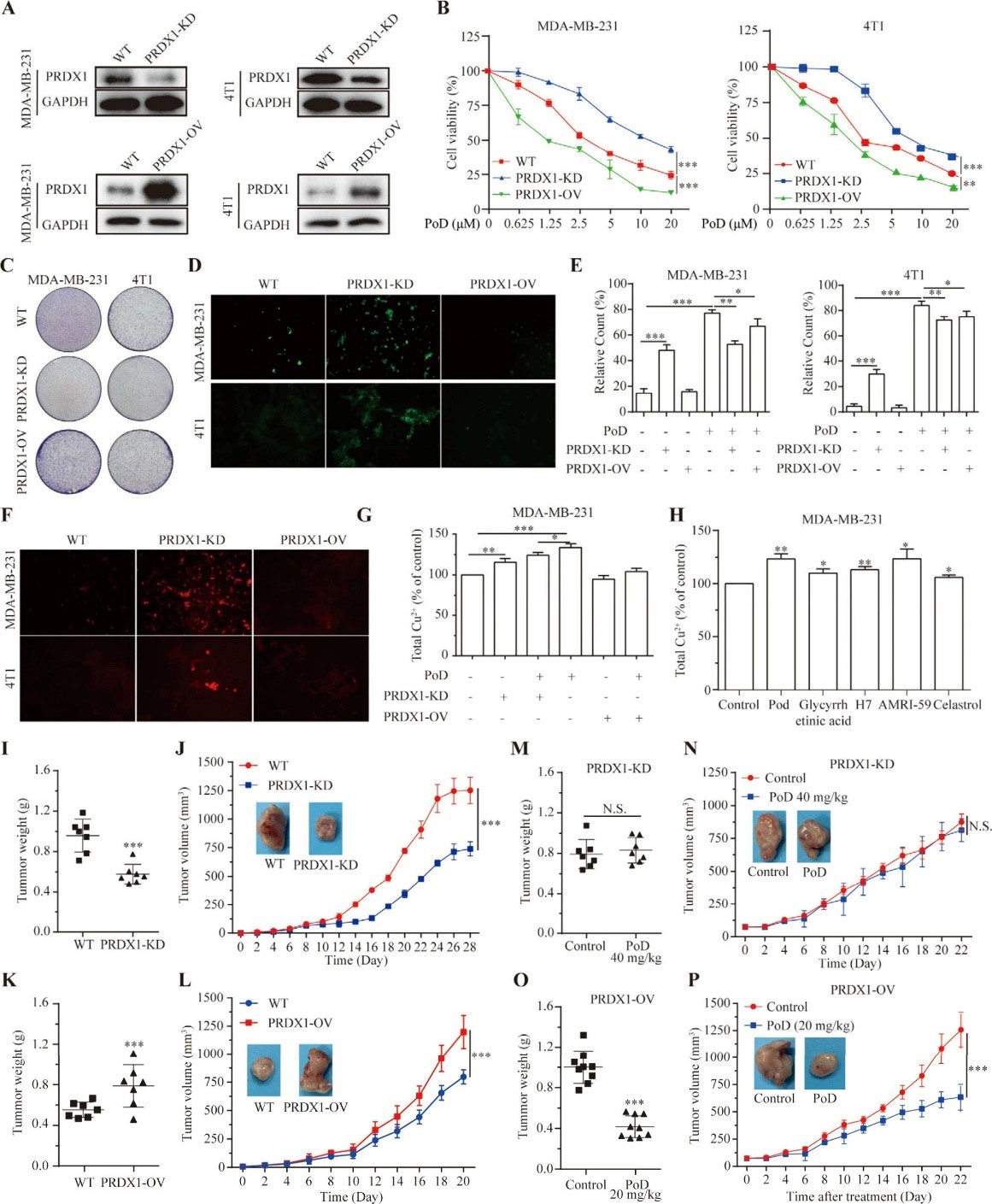
體外實驗:PoD對六種人類癌細胞系有顯著細胞毒性,,對TNBC細胞系有劑量和時間依賴性抑制活性,對正常乳腺細胞MCF-10A毒性較低,。
結構-活性關系研究表明,,α,β-不飽和酮基、C-4-C-5的環(huán)氧結構和雙鍵,、C-13的氯原子等對活性有重要影響,。PoD可劑量依賴性降低
MDA-MB-231和4T1細胞的克隆形成能力,使細胞周期阻滯在G2/M期,,誘導細胞凋亡,。
體內(nèi)實驗:建立TNBC異種移植小鼠模型,PoD劑量依賴性抑制腫瘤生長,,降低腫瘤重量和體積,,且在有效劑量下無明顯毒性,。

3. PoD觸發(fā)TNBC細胞銅死亡
通過RNA測序和CMap數(shù)據(jù)庫分析,,發(fā)現(xiàn)PoD與已知銅死亡誘導劑雙硫侖正相關,能顯著影響銅死亡相關調(diào)控基因,。
細胞銅比色測定和熒光顯微鏡成像顯示PoD增加細胞內(nèi)銅含量,,銅增強PoD對TNBC細胞的細胞毒性,銅螯合劑TM可減弱其毒性,。
分光光度滴定和化學位移變化表明PoD與銅結合,。

4. PRDX1是PoD的直接靶點且在TNBC中高表達
利用生物素標記的PoD探針和質(zhì)譜分析,確定PRDX1是PoD的潛在靶點,。OTTER分析也富集到PRDX1及相關相互作用蛋白,。
TCGA數(shù)據(jù)和免疫組織化學分析顯示PRDX1在乳腺癌中高表達,且高表達與患者預后不良和生存期短相關,。

5. PoD與PRDX1的結合特性
微尺度熱泳(MST),、等溫滴定量熱法(ITC),、細胞熱位移分析(CETSA)和藥物親和力響應性靶點穩(wěn)定性(DARTS)
實驗表明PoD與PRDX1有高親和力結合,抑制PRDX1的酶活性,,誘導細胞內(nèi)活性氧(ROS)積累,。

6. PoD與PRDX1的共價結合位點
對比PoD和缺乏α,β - 不飽和酮基的衍生物,表明PoD的細胞毒性依賴于該基團,。
對接模擬和MST,、CETSA、DARTS及下拉實驗確定PoD通過α,β - 不飽和酮基與PRDX1的Cys173共價結合,。

7. PRDX1在TNBC中的生理功能及PoD的抗癌機制
構建PRDX1敲低(PRDX1 - KD)和過表達(PRDX1 - OV)的TNBC細胞,,發(fā)現(xiàn)PRDX1表達影響細胞增殖,PoD對細胞增殖的抑制
作用依賴于PRDX1表達水平,。
PRDX1 - KD細胞中ROS和銅離子水平升高,,PoD誘導的銅離子升高在PRDX1 - KD細胞中減弱。其他PRDX1抑制劑也能誘導不同
程度的銅離子積累,。
小鼠模型實驗表明PRDX1影響體內(nèi)腫瘤生長,,PoD對TNBC細胞的抗癌作用依賴于PRDX1。
研究結論:
本文從植物內(nèi)生真菌中分離出24種間苯二酸內(nèi)酯(RALs),,其中9種為新發(fā)現(xiàn),。Pochonin D(PoD)能有效抑制三陰性乳腺癌(TNBC)
細胞增殖,誘導細胞凋亡和銅死亡,。PRDX1是PoD的直接靶點,,PoD通過與PRDX1的Cys173位點共價結合,抑制其酶活性,,干預
銅死亡過程,,發(fā)揮抗TNBC活性。PRDX1是與銅死亡相關的生物標志物和治療靶點,,PoD是新型銅離子載體,。
研究的創(chuàng)新性:
從植物內(nèi)生真菌中分離出9種新的RALs,化合物1 - 6具有du特的E構型,,為化學研究提供新見解,。
發(fā)現(xiàn)PoD能誘導TNBC細胞銅死亡,且PRDX1是其作用靶點,,為TNBC治療提供新策略,。
PoD對PRDX1有高選擇性和良好體內(nèi)安全性,是研究PRDX1抑制機制的合適工具,。
研究的不足之處:
雖發(fā)現(xiàn)PRDX1抑制劑可誘導銅離子積累,,但未深入探究其具體過程和機制,缺乏更詳細的實驗驗證,。
研究主要集中在細胞和小鼠模型,,未開展臨床試驗,,PoD在人體中的療效和安全性有待進一步研究。
研究展望:
深入研究PRDX1抑制劑誘導銅離子積累的具體分子機制,,明確其在銅死亡中的作用,。
開展PoD的臨床試驗,評估其在人體中的療效和安全性,,為TNBC治療提供臨床依據(jù),。
基于PoD和RALs的結構,進行結構優(yōu)化和改造,,開發(fā)更高效,、低毒的抗TNBC藥物。
研究意義:
本研究為TNBC治療提供了新的藥物靶點和治療策略,。發(fā)現(xiàn)的新RALs和PoD為開發(fā)新型抗癌藥物提供了基礎,。
明確PRDX1與銅死亡的關系,有助于深入理解TNBC的發(fā)病機制,,為TNBC的精準治療提供理論支持,。
參考文獻
Feng L, Wu T, Guo X, et al. Discovery of Natural Resorcylic Acid Lactones as Novel Potent Copper Ionophores
Covalently Targeting PRDX1 to Induce Cuproptosis for Triple-Negative Breast Cancer Therapy[J]. ACS Cent Sci,
2025,11(2):357-370.

