技術文章
研究揭示TET同源蛋白催化DNA中5mC形成
閱讀:365 發(fā)布時間:2021-3-312月2日,中國科學院分子細胞科學創(chuàng)新中心(生物化學與細胞生物學研究所)研究員丁建平研究組在Nature Communications上發(fā)表題為Molecular mechanism for vitamin C-derived C5-glyceryl-methylcytosine DNA modification catalyzed by algal TET homologue CMD1的論文,,該研究揭示了衣藻中TET同源蛋白CMD1以維生素C作為共底物(co-substrate),,催化DNA中5mC修飾形成5gmC修飾的分子機制。
近年來,,表觀遺傳學研究領域致力于發(fā)現(xiàn)新型DNA修飾方式,。研究表明,TET蛋白利用Fe2+和2-酮戊二酸(2-oxogluatarate, 2-OG)能夠催化5mC發(fā)生多步氧化反應,,依次形成5hmC,、5fC以及5caC。2019年,,中國科學院院士徐國良等多個課題組合作研究發(fā)現(xiàn),,萊茵衣藻(Chlamydomonas reinhardtii)中TET同源蛋白CMD1(5-methylcytosine modifying enzyme 1)能夠以維生素C(vitamin C, VC)為共反應底物,催化DNA的5mC產(chǎn)生一種全新的DNA修飾5gmC(5-glyceryl-methylcytosine),,并在萊茵衣藻的光合作用中發(fā)揮重要調(diào)節(jié)作用。CMD1作為2-OG依賴的雙加氧酶家族成員,,催化5mC形成5gmC需要VC而非2-OG,,這與該家族其他成員顯著不同。在CMD1被報道之前,,VC主要作為抗氧化劑發(fā)揮功能,,或作為還原劑促進2-OG依賴的雙加氧酶的催化活性,未有研究表明VC能夠作為共反應底物發(fā)揮生物學功能,。CMD1如何利用VC而非2-OG催化5mC發(fā)生修飾,,以及CMD1是否具有底物特異性等科學問題及其分子機制尚不清楚。
丁建平研究組助理研究員李文婧,、研究員張?zhí)忑埡筒┦垦芯可鷮O明亮合作對CMD1的結(jié)構,、功能和分子機制開展了深入研究。通過生化分析發(fā)現(xiàn),,CMD1對不同長度,、結(jié)構及5mC修飾水平的DNA底物具有相近的親和力,但對含有5mCpG的DNA有一定程度的底物偏好性,。此外,,科研人員解析了CMD1原酶、結(jié)合VC,、結(jié)合DNA或5mC-DNA,、以及結(jié)合5mC-DNA和VC的復合物的高分辨率晶體結(jié)構,。結(jié)構分析表明,CMD1的整體結(jié)構采用典型的2-OG依賴的雙加氧酶家族的DSBH(double-stranded β-helix)折疊方式,。在CMD1結(jié)合VC以及結(jié)合5mC-DNA和VC的復合物結(jié)構中,,VC均以內(nèi)酯形式存在。相互作用分析表明,,VC通過廣泛的氫鍵和疏水相互作用結(jié)合在CMD1的活性位點,,并通過單配位與Fe2+螯合,這與其他2-OG依賴的雙加氧酶中2-OG以雙配位與Fe2+螯合的方式不同,。體外酶活實驗表明,,CMD1催化的反應只有當VC以內(nèi)酯形式存在時才能發(fā)生。CMD1-VC-5mC-DNA三元復合物的結(jié)構代表了CMD1催化反應的起始狀態(tài),,在該結(jié)構中DNA底物主要通過磷酸骨架與CMD1正電荷富集的表面相互作用,,DNA底物鏈中的5mC從雙鏈DNA中翻轉(zhuǎn)出來并插入CMD1的活性位點;5mC的甲基基團指向VC,,但沒有被特異性識別,,因此未修飾的C也能夠插入CMD1的活性位點。突變體實驗表明,,CMD1的催化活性依賴于金屬離子,、VC和DNA底物的正確結(jié)合。與TET蛋白的結(jié)構比較闡明了CMD1和TET蛋白使用不同共反應底物催化反應的結(jié)構基礎,,但CMD1和TET蛋白對底物5mC的結(jié)合和識別方式卻十分相似,。上述研究結(jié)果揭示了CMD1以VC為共底物,催化DNA中5mC修飾形成5gmC修飾的分子機制,。
分子細胞中心徐國良研究組參與了該項研究,。研究工作得到上海同步輻射光源BL17U1線站和國家蛋白質(zhì)科學研究設施(上海)BL18U和BL19U1線站、分子細胞中心分子平臺的支持,,以及中科院戰(zhàn)略性先導科技專項(B類)和科學技術部國家重點研發(fā)計劃的支持,。
論文鏈接
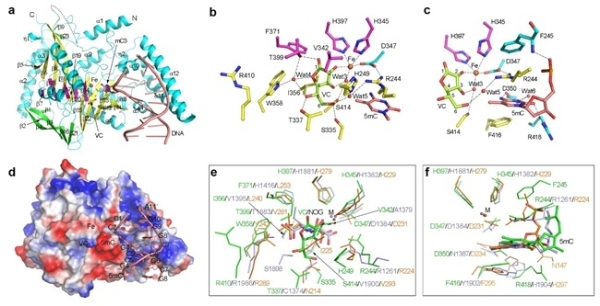
(a) CMD1-VC-5mC-DNA三元復合物的整體結(jié)構。(b, c) CMD1的活性位點,。(d) CMD1的表面電勢分布以及與5mc-DNA的結(jié)合方式,。(e, f) CMD1與TET蛋白活性位點的結(jié)構比較(綠色:CMD1;淺藍色:HsTET2,;橙色:NgTET1),。
 化工儀器網(wǎng)
化工儀器網(wǎng)