技術文章
NLRP3和pyrin炎性體的MTOC定位所發(fā)揮的雙重激活和抑制作用
閱讀:790 發(fā)布時間:2020-9-30典型炎性體是一種多組分蛋白復合物,通過活化caspase-1,,在對感染和危險的免疫監(jiān)控中發(fā)揮關鍵作用,。活化的caspase-1裂解白細胞介素1(IL-1)和成孔蛋白gasdermin D,,從而導致細胞因子成熟和細胞焦亡,。核苷酸結合結構域、富含亮氨酸的重復序列和含熱蛋白(pyrin)結構域的蛋白3(NLRP3)可被尼日利亞菌素nigericin),、細胞外ATP和尿酸單鈉(MSU)晶體,、明礬、二氧化硅和淀粉樣蛋白等各種微粒激活,,而pyrin炎性體可被艱難梭菌毒素B的Rho-葡糖基化活性所刺激,。炎性體激活的一個重要特征是每個細胞形成單個超分子點狀物(也稱為斑點)。然而,,這類點狀物的位置和轉運仍然是未知的,。
在一項新的研究中,為了破解巨噬細胞中炎性體組裝和激活的部位和分子機制,,來自美國哈佛醫(yī)學院,、波士頓兒童醫(yī)院,、密歇根大學、馬薩諸塞大學,、中國中南大學,、挪威科技大學和德國波恩大學的研究人員通過細胞成像,輔以細胞和小鼠中的藥物抑制和靶向剔除,,可視化觀察炎性體組裝,。
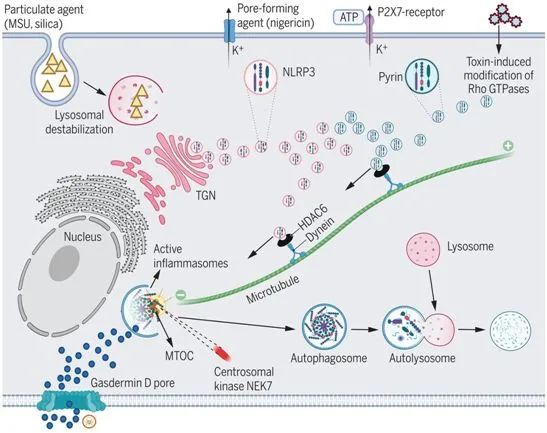
這些研究人員發(fā)現NLRP3和pyrin炎性體在每個細胞的中心體中組裝,中心體也被稱為微管組織中心(MTOC),,是caspase-1活化和IL-1β轉化的主要場所,。微管聚合,、動力蛋白ATP酶和動力蛋白銜接蛋白---組蛋白去乙?;?(HDAC6)---的藥理學抑制劑,以及Hdac6的靶向剔除或敲降,,都會損害這些炎性體的組裝和激活,。對Hdac6-/-巨噬細胞的重建表明HDAC6的泛素結合能力,而不是它的去乙?;富钚?,是NLRP3和pyrin炎性體激活所必需的。
在小鼠中,,Hdac6的缺失可減少脂多糖和尿酸單鈉誘導的炎癥,,其程度與直接抑制NLRP3相似,這表明HDAC6和微管逆向運輸機制是NLRP3激活所必需的,。相比之下,,AIM2和NLRC4炎性體點狀物并不定位在MTOC中,這些炎性體的激活不需要微管逆向運輸,。因此,,這項研究揭示了NLRP3和pyrin炎性體的特異性激活機制。
對于NLRP3炎性體而言,,MTOC定位可能促進與定位于中心體的激酶NEK7的結合,,從而增強炎性體組裝。這些研究人員發(fā)現在Hdac6-/-巨噬細胞中,,NLRP3在反面高爾基體網絡(trans-Golgi network, TGN)中以小斑點的形式被捕獲,,TGN是以前*的經多種NLRP3刺激物誘導后的常見NLRP3結合部位。
這些數據表明,,HDAC6介導的微管運輸將NLRP3從TGN輸送到MTOC,。在MTOC形成的NLRP3炎性體與LC3b(一種自噬標志物物)共定位,而且自噬抑制劑可增強NLRP3誘導的IL-1β分泌,。
總之,,這項研究揭示了HDAC6依賴性的NLRP3和pyrin炎性體組裝與MTOC中的聚集體(aggresome)形成之間存在著意想不到的平行關系,,所形成的聚集體可用于泛素化病理聚集物的自噬降解。NLRP3和pyrin炎性體的MTOC定位所發(fā)揮的雙重激活和抑制作用可能是實現炎性體平衡調節(jié)的關鍵,。
 化工儀器網
化工儀器網