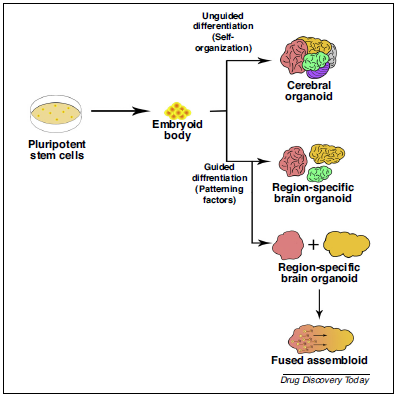
腦類器官通常從人多能性干細(xì)胞(ESCs/iPSCs)開始培養(yǎng),自發(fā)形成腦發(fā)育早期所具備的結(jié)構(gòu)和層次,。但腦細(xì)胞團(tuán)簇達(dá)到一定尺寸后,,可發(fā)育的階段會(huì)受到營養(yǎng)缺乏和氧供應(yīng)的限制,繼而神經(jīng)元開始死亡,,結(jié)構(gòu)停止發(fā)育,。 目前,大腦類器官的培養(yǎng)主要分為兩種方法,,引導(dǎo)分化法 (Guided)和非引導(dǎo) (Un-guided)分化法,。 ①非引導(dǎo)分化法依賴于細(xì)胞自身的形態(tài)發(fā)生和內(nèi)在的分化能力,將外在干擾小化,,得到的類器官有前腦,、中腦、后腦,、視網(wǎng)膜和脈絡(luò)叢等多種細(xì)胞譜系,,該種方法的缺陷在于高可變性和異質(zhì)性。 ②而引導(dǎo)分化法是加入一些外源性的模式因子,,誘導(dǎo)hPSCs分化為想要的細(xì)胞譜系,。 在類器官結(jié)構(gòu)中,多能性干細(xì)胞(ESCs/iPSCs)誘導(dǎo)為擬胚體 (Embryoid Body, EB),,在外胚層形成后,,引導(dǎo)分化為神經(jīng)或非神經(jīng)方向。引導(dǎo)分化法獲得的類器官依賴分化過程中添加的生長因子,,大多數(shù)是腦區(qū)特異性的,,如皮層、海馬,、中腦,、大腦等。引導(dǎo)分化法得到的類器官含有神經(jīng)祖細(xì)胞,、神經(jīng)元,、星形膠質(zhì)細(xì)胞及其他的大腦細(xì)胞。由于是引導(dǎo)性分化,,批次間的可變因素少,,可以產(chǎn)生對(duì)應(yīng)比例的特異性細(xì)胞類型。很多團(tuán)隊(duì)都在嘗試用不同的方法來培養(yǎng)類器官,,分別培養(yǎng)腦區(qū)特異的類器官后再將其共培養(yǎng),,類器官會(huì)自我融合形成含有不同腦區(qū)的類器官,該模型可以用于研究腦區(qū)間的相互作用,。 |
誘導(dǎo)EB形成 1-2h | 1. 當(dāng)ESCs/iPSCs在六孔板中長到融合度為70-80%時(shí)用于誘導(dǎo)EB,,通常每個(gè)六孔板孔的細(xì)胞可用于誘導(dǎo)一整個(gè)96孔板,。
注:干細(xì)胞克隆的形態(tài)對(duì)于大腦組織形成的成功與否非常關(guān)鍵??寺⌒璩尸F(xiàn)多能性的特征 (如邊緣清晰,,克隆緊密等),且無分化傾向,;
對(duì)于無飼養(yǎng)層培養(yǎng)的ESCs/iPSCs:
① 用1ml的無鈣鎂的D-PBS洗滌細(xì)胞后,,向每孔中加入600μl的含0.5mM的EDTA的無鈣鎂的D-PBS溶液。培養(yǎng)箱孵育4min,;
② 輕柔吸出EDTA溶液,,注意不要破壞克隆,加入1ml的Accutase,。放回培養(yǎng)箱孵育4min,;
③ 用1ml的mTeSR1培養(yǎng)基吹散克隆,,使其從培養(yǎng)皿底部脫落。轉(zhuǎn)移2ml至15ml離心管中,,用1ml移液器將克隆吹散為渾濁的單細(xì)胞懸液,;
④ 270g 室溫離心細(xì)胞5min,同時(shí)用臺(tái)盼藍(lán)檢測(cè)死細(xì)胞,,用血細(xì)胞儀或自動(dòng)細(xì)胞計(jì)數(shù)儀細(xì)胞計(jì)數(shù),;檢測(cè)兩次取平均值;
⑤ 用1ml的含50μM的ROCK抑制劑Y-27632的低bFGF的ESCs培養(yǎng)基重懸細(xì)胞,,吹打,,保證細(xì)胞呈單細(xì)胞重懸的狀態(tài)。然后,,用含Y-7632的低FGF-2的培養(yǎng)基重懸細(xì)胞,,使細(xì)胞濃度為每150μl含9000個(gè)活細(xì)胞;
⑥ 每個(gè)96孔板孔中放入150μl的細(xì)胞懸液,,置于培養(yǎng)箱繼續(xù)培養(yǎng),; | 飼養(yǎng)EB,早期胚層分化 5-7d | 2. 24h后,顯微鏡下觀察,可見有清晰邊緣的小的EB形成,邊緣有許多死細(xì)胞圍繞在EB周圍,為正?,F(xiàn)象,,不會(huì)干擾EB在中間形成,繼續(xù)置于37℃的5%二氧化碳的培養(yǎng)箱中培養(yǎng);
3. 隔天輕柔地吸去半量培養(yǎng)基,避免干擾到EB和底部的細(xì)胞,補(bǔ)充150μl的新鮮培養(yǎng)基(總體積會(huì)大于150μl,量的準(zhǔn)確與否不重),培養(yǎng)基中添加Y-27632(1:100),FGF-2濃度為4ng/ml,直到EB直徑大于350-450μm為止,通常,僅前4天需要添加二者,;
4. EB直徑達(dá)到350-600μm時(shí),,用3中的培養(yǎng)基隔天飼養(yǎng)EB,培養(yǎng)基中不含Y-27632和FGF-2; | 原始神經(jīng)上皮的誘導(dǎo) 4-5d | 5. EB直徑達(dá)到500-600μm時(shí),,邊緣開始變得明亮,,并且呈現(xiàn)光滑的邊緣 (通常為第6天),將每個(gè)EB用剪掉槍頭的200μl移液器轉(zhuǎn)移至含有500μl的神經(jīng)誘導(dǎo)培養(yǎng)基的低吸附24孔板中,,輕柔且不要破壞EB,,繼續(xù)培養(yǎng); 注:將200μl移液器槍頭剪掉,,使開口直徑約為1-1.5mm,。確保開口不要太小,避免破壞EB,,但也不能太大,,太大會(huì)難以吸去EB。不要試圖用刮刀將EB鏟出,,會(huì)破壞EB的結(jié)構(gòu),;
6. 轉(zhuǎn)移至24孔板后,另外加入500μl的神經(jīng)誘導(dǎo)培養(yǎng)基飼養(yǎng)EB;
7. 2d后,,組織培養(yǎng)顯微鏡觀察EBs,,形態(tài)邊緣變得更加明亮,提示神經(jīng)外胚層的分化,;一旦這些區(qū)域開始顯示與神經(jīng)上皮形成一致的假復(fù)層上皮的放射狀組織,,這一般發(fā)生在神經(jīng)誘導(dǎo)培養(yǎng)基中的4-5d后,,繼續(xù)進(jìn)行第8步,,將組織聚集轉(zhuǎn)移到Matrigel液滴中;
注:健康的細(xì)胞聚集有光滑的邊緣,,神經(jīng)上皮邊緣在光學(xué)上呈半透明狀,。有時(shí)組織可能在光學(xué)上表現(xiàn)為非放射狀組織的半透明組織,雖然這不是理想狀態(tài),,但沒有觀察到這對(duì)類器官形成有長期的負(fù)面影響,。重要的是,如果在神經(jīng)誘導(dǎo)中再多放置1-2天,,這些非放射區(qū)域就會(huì)變成放射狀,,但是如果不及時(shí)轉(zhuǎn)移到基質(zhì)凝膠(步驟8),其他已經(jīng)放射狀的區(qū)域可能開始收縮并失去形成神經(jīng)上皮芽的能力,。當(dāng)有神經(jīng)外胚層出現(xiàn)時(shí),,需盡快將組織轉(zhuǎn)移到Matrigel中,如果太晚,,會(huì)影響腦組織的晚期形態(tài),; | 將神經(jīng)外胚層組織轉(zhuǎn)移至Matrigel液滴中 1-2h | 8. 4℃下冰上解凍Matrigel。觀察發(fā)現(xiàn),,500μl的Matrigel在冰水混合物浴時(shí),,1-2h后會(huì)恢復(fù)液體狀態(tài); 9. 將Parafilm膜置于一個(gè)空的帶有凹坑的中號(hào)槍頭盒上,,將手指按向Parafilm膜形成凹坑,,每個(gè)坑的體積約為200μl;
注:Parafilm不能高壓滅菌,,所以不能*滅菌,,因此需保證Parafilm膜保存在干凈的環(huán)境中,準(zhǔn)備凹坑前,,向手套和Parafilm膜噴灑70%乙醇消毒,;在這一步也可以在培養(yǎng)基中添加抗生素以避免污染;
10. 將Parafilm膜用剪刀修剪為單個(gè)含4x4(共16個(gè))凹坑大小的正方形,,將其放入60mm的組織培養(yǎng)皿中,;
11. 用200μl的移液器轉(zhuǎn)移神經(jīng)外胚層組織,每個(gè)凹坑中放置1個(gè);
注:將200μl移液器槍頭剪掉,,使開口直徑約為1.5-2mm,。確保開口不要太小,避免破壞EB,,但也不能太大,,太大會(huì)難以吸去EB。不要試圖用刮刀將EB鏟出,,會(huì)破壞EB的結(jié)構(gòu),;
12. 用未剪頭部的200μl移液器小心地吸去組織邊緣多余的培養(yǎng)基;
13. 每個(gè)組織快速滴入Matrigel,,每孔約30μl,,使Matrigel滴入Parafilm凹坑中;
注:快速滴入Matrigel,,避免組織干掉,。盡量一次性滴入Matrigel,一次性包埋好16個(gè)組織,;
14. 用10μl的移液槍頭移動(dòng)組織,,使組織位于液滴的中央,這一步需要在滴入Matrigel后立即進(jìn)行,,因?yàn)槭覝叵翸atrigel非常容易固化,;
15. 將此60mm培養(yǎng)皿置入37℃培養(yǎng)箱中,孵育20-30min以使Matrigel聚合,;
16. 取出60mm培養(yǎng)皿,,加入5ml不含Vitamin A的腦類器官分化培養(yǎng)基;
17.將Parafilm膜反過來并搖動(dòng)培養(yǎng)皿,,直至Matrigel液滴從凹坑中滴入培養(yǎng)基中,;不容易脫落的液滴可以用鑷子用力晃動(dòng)Parafilm膜使其脫落,將培養(yǎng)皿置于培養(yǎng)箱中繼續(xù)培養(yǎng)組織,。 | 神經(jīng)上皮芽的固定培養(yǎng) 4d | 18. 24h后,,觀察包埋的組織,1-3d內(nèi),,組織會(huì)呈現(xiàn)包含液體空腔的進(jìn)一步擴(kuò)張的神經(jīng)上皮樣,; 注:從Matrigel主體中會(huì)遷移出一些細(xì)胞類型,通常呈成纖維細(xì)胞樣,,這些細(xì)胞代表了非神經(jīng)特性的群體,,從神經(jīng)誘導(dǎo)時(shí)逃脫出來;然而這些細(xì)胞通常不能生存,,且遷移出來后,,對(duì)神經(jīng)上皮芽的形成呈現(xiàn)促進(jìn)作用,;
19. 將液滴繼續(xù)培養(yǎng)24h,然后將培養(yǎng)基更換為不含Vitamin A的腦類器官分化培養(yǎng)基,,繼續(xù)培養(yǎng)48h,;
注:換液時(shí),傾斜培養(yǎng)皿使液滴下沉,,輕柔吸出培養(yǎng)液,。盡量在不破壞類器官的情況下,吸出更多的培養(yǎng)液,。更換為5ml的新鮮培養(yǎng)液,; | 腦組織的生長 ~1年 | 20. 4h的靜止培養(yǎng)后,用開口約為3mm的剪去頭部的1ml移液槍頭將包埋好的類器官轉(zhuǎn)移至125ml的震動(dòng)反應(yīng)器中,,加入75~100ml的含Vitamin A的腦類器官分化培養(yǎng)液,,將此生物反應(yīng)器放置在培養(yǎng)箱中安裝的磁攪拌板或軌道振動(dòng)篩上用85rpm的速度震動(dòng)。也可以將60mm的培養(yǎng)皿中培養(yǎng)液更換為含Vitamin A的腦類器官培養(yǎng)液,,將其置于軌道振動(dòng)篩上培養(yǎng); 注:每個(gè)生物反應(yīng)器中不要轉(zhuǎn)移超過2個(gè)60mm培養(yǎng)皿的類器官(32個(gè)),,太多類器官會(huì)引起類器官的融合,;
使用低速攪拌攪拌板,因?yàn)槌R?guī)速度的攪拌棒會(huì)因磁力攪拌而引起發(fā)熱,;
軌道振動(dòng)篩可用于分析多種培養(yǎng)條件,,同時(shí)使用多種基因突變劑處理,而傳統(tǒng)的攪拌板只能同時(shí)防止4-6個(gè)單獨(dú)的瓶,;用生物反應(yīng)器和軌道振動(dòng)篩培養(yǎng)的腦類器官未觀測(cè)到有區(qū)別,;
21. 振動(dòng)篩上的類器官每3-4天全量換液,搖瓶上的類器官每周換液,,注意觀察形態(tài),;在合適的時(shí)間點(diǎn)取樣本用于實(shí)驗(yàn)研究; |
|


 您好, 歡迎來到化工儀器網(wǎng)
您好, 歡迎來到化工儀器網(wǎng)

會(huì)員.png) 8
8