技術(shù)文章
化學(xué)元素周期表的說(shuō)明和審查
閱讀:580 發(fā)布時(shí)間:2021-5-13在化學(xué)元素周期表中的一個(gè)重要工具。這些筆記復(fù)習(xí)的周期表,,它是如何組織的,,和元素周期表趨勢(shì)的。
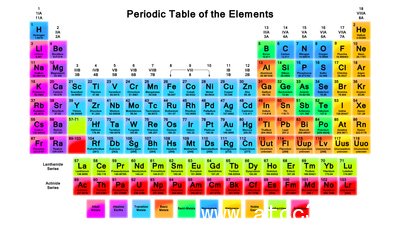
周期表中的發(fā)明和組織1869年,,門捷列夫組織成元素周期表的化學(xué)元素,,就像我們今天使用的,除責(zé)令他的元素按照原子量增加,,而現(xiàn)代表增加原子序數(shù)組織,。元素組成的方式,使得它可以看元素屬性的趨勢(shì),,并預(yù)測(cè)在化學(xué)反應(yīng)中的行為的元素,。
排(從左至右)被稱為周期。在一段時(shí)間內(nèi)的元素共享相同的能量水平最高的為未激發(fā)電子。有是更多的能級(jí)每個(gè)原子大小的增加能量水平,,所以有更多的元素在周期表進(jìn)一步回落,。
列(從上到下移動(dòng))形成的基礎(chǔ)元件組。組中的元素共享相同數(shù)目的價(jià)電子或外層電子層排布,,這給元素組中的一些通用屬性,。元素組的例子是堿金屬和惰性氣體。
周期表中的趨勢(shì)或周期周期表中的組織使得人們有可能看到的元素的屬性的趨勢(shì)一目了然,。最重要的發(fā)展趨勢(shì)與原子半徑,,電離能,電負(fù)性,,電子親和,。

原子半徑:原子半徑反映原子的大小。原子半徑減小移動(dòng)從左至右橫跨一段下跌元素組從上到下增加,。雖然也許你認(rèn)為原子只會(huì)變得更大,,因?yàn)樗麄儷@得了更多的電子,電子留在一個(gè)空殼,,而越來(lái)越多的質(zhì)子在接近細(xì)胞核拉彈。向下移動(dòng)一組時(shí),,電子被進(jìn)一步從細(xì)胞核在新能源彈,,所以原子的整體尺寸增加。
電離能是從在氣體狀態(tài)下的離子或原子中移走一個(gè)電子所需的能量,。電離能增加在周期中從左至右移動(dòng),,并減小移動(dòng)從上到下向下一個(gè)組。
電負(fù)性是衡量一個(gè)原子形成化學(xué)鍵是多么容易,。較高的電負(fù)性,,較高的吸引力用于粘接的電子。電負(fù)性減小向下移動(dòng)一個(gè)單元組,。對(duì)左側(cè)的元素周期表的第傾向于是正電性或捐贈(zèng)一個(gè)電子,,而不是接受一個(gè)更容易。
電子親合反映容易原子接受電子,。電子親和能根據(jù)不同的元素組,。惰性氣體的電子親和,因?yàn)樗麄円呀?jīng)接近零填補(bǔ)電子層,。鹵素有高的電子親和能,,因?yàn)榱硗獾碾娮咏o一個(gè)原子一個(gè)*充滿的電子層。
 化工儀器網(wǎng)
化工儀器網(wǎng)