PH計(jì)測(cè)量原理
PH計(jì),,是一種常用的儀器設(shè)備,主要用來精密測(cè)量液體介質(zhì)的酸堿度值,,配上相應(yīng)的離子選擇電極也可以測(cè)量離子電極電位MV值,,廣泛應(yīng)用于工業(yè)、農(nóng)業(yè),、科研,、環(huán)保等領(lǐng)域。該儀器也是食品廠,、飲用水廠辦QS,、HACCP認(rèn)證中的*檢驗(yàn)設(shè)備。
原理
什么是pH,?pH是拉丁文“Pondus hydrogenii”一詞的縮寫(Pondus=壓強(qiáng)、壓力hydrogenium=氫),,用來量度物質(zhì)中氫離子的活性,。這一活性直接關(guān)系到水溶液的酸性、中性和堿性,。水在化學(xué)上是中性的,,但不是沒有離子,,即使化學(xué)純水也有微量被離解:嚴(yán)格地講,只有在與水分子水合作用以前,,氫核不是以自由態(tài)存在,。
H2O+ H2O=H3O+ + OHˉ
由于水合氫離子(H3O)的濃度是與氫離子(H)濃度等同看待,上式可以簡(jiǎn)化成下述常用的形式: H2O=H+ + OHˉ
此處正的氫離子人們?cè)诨瘜W(xué)中表示為“H+離子”或“氫核”,。水合氫核表示為“水合氫離子”,。負(fù)的氫氧根離子稱為“氫氧化物離子”。
利用質(zhì)量作用定律,,對(duì)于純水的離解可以找到一平衡常數(shù)加以表示:
K=H3O+×OH————H2O
由于水只有極少量被離解,,因此水的克分子濃度實(shí)際為一常數(shù),并且有平衡常數(shù)K可求出水的離子積KW,。
KW=K×H2O KW= H3O+·OH-=10-7·10-7=10-14mol/l(25℃)
也就是說對(duì)于一升純水在25℃時(shí)存在10-7摩爾H3O+離子和10-7摩爾OHˉ離子,。
在中性溶液中,氫離子H+和氫氧根離子OHˉ的濃度都是10-7mol/l,。假如有過量的氫離子H+,,則溶液呈酸性。酸是能使水溶液中的氫離子H+游離的物質(zhì),。同樣,,如果使OHˉ離子游離,那么溶液就是堿性的,。所以,,給出H+值就足以表示溶液的特性,呈酸性還是堿性,,為了免于用此分子濃度負(fù)冥指數(shù)進(jìn)行運(yùn)算,,生物學(xué)家澤倫森(Soernsen)在1909年建議將此不便使用的數(shù)值用對(duì)數(shù)代替,并定義為“pH值”,。數(shù)學(xué)上定義pH值為氫離子濃度的常用對(duì)數(shù)負(fù)值,。即pH=-log[H+]。
因此,,pH值是離子濃度以10為底的對(duì)數(shù)的負(fù)數(shù):
改變50m3的水的pH值,,從pH2到pH3需要500L漂白劑。然而,,從pH6到pH7只需要50L的漂白劑,。
測(cè)量pH值的方法很多,主要有化學(xué)分析法,、試紙法,、電位法。現(xiàn)主要介紹電位法測(cè)得pH值,。
電位分析法所用的電極被稱為原電池,。原電池是一個(gè)系統(tǒng),,它的作用是使化學(xué)反應(yīng)能量轉(zhuǎn)成為電能。此電池的電壓被稱為電動(dòng)勢(shì)(EMF),。此電動(dòng)勢(shì)(EMF)由二個(gè)半電池構(gòu)成,,其中一個(gè)半電池稱作指示電極,它的電位與特定的離子活度有關(guān),,如H+,;另一個(gè)半電池為參比半電池,通常稱作參比電極,,它一般是測(cè)量溶液相通,,并且與測(cè)量儀表相連。
例如,,一支電極由一根插在含有銀離子的鹽溶液中的一根銀導(dǎo)線制成,,在導(dǎo)線和溶液的界面處,由于金屬和鹽溶液二種物相中銀離子的不同活度,,形成離子的充電過程,,并形成一定的電位差。失去電子的銀離子進(jìn)溶液,。當(dāng)沒有施加外電流進(jìn)行反充電,,也就是說沒有電流的話,這一過程終會(huì)達(dá)到一個(gè)平衡,。在這種平衡狀態(tài)下存在的電壓被稱為半電池電位或電極電位,。這種(如上所述)由金屬和含有此金屬離子的溶液組成的電極被稱為類電極。
此電位的測(cè)量是相對(duì)一個(gè)電位與鹽溶液的成分無關(guān)的參比電極進(jìn)行的,。這種具有獨(dú)立電位的參比電極也被稱為第二電極,。對(duì)于此類電極,金屬導(dǎo)線都是覆蓋一層此種金屬的微溶性鹽(如:Ag/Agcl),,并且插入含有此種金屬鹽陰離子的電解質(zhì)溶液中,。此時(shí)半電池電位或電極電位的大小取決于此種陰離子的活度。
此二種電極之間的電壓遵循能斯特(NERNST)公式:
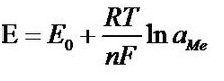
能斯特公式
式中:E—電位
E0—電極的標(biāo)準(zhǔn)電壓
R—氣體常數(shù)(8.31439焦耳/摩爾和℃)
T—開氏溫度(例:20℃相當(dāng)于(273.15+20)293.15開爾文)
F—法拉弟常數(shù)(96493庫化/當(dāng)量)
n—被測(cè)離子的化合價(jià)(銀=1,,氫=1)
ln(aMe)—離子活度aMe的對(duì)數(shù)
標(biāo)準(zhǔn)氫電極是所有電位測(cè)量的參比點(diǎn),。標(biāo)準(zhǔn)氫電極是一根鉑絲,用電解的方法鍍(涂覆)上氯化鉑,,并且在四周充入氫氣(固定壓力為1013hpa)構(gòu)成的,。
將此電極浸入在25℃時(shí)H3O+離子含量為1mol/l溶液中便形成電化學(xué)中所有電位測(cè)量所參照的半電池電位或電極電位。其中氫電極作為參比電極在實(shí)踐中很難實(shí)現(xiàn),,于是使用第二類電極做為參比電極,。其中常用的便是銀/氯化銀電極。該電極通過溶解的AgCl對(duì)于氯離子濃度的變化起反應(yīng),。
此參比電極的電極電位通過飽和的kcl貯池(如:3mol/l kcl)來實(shí)現(xiàn)恒定,。液體或凝膠形式的電解質(zhì)溶液通過隔膜與被測(cè)溶液相連通。
利用上述的電極組合—銀電極和Ag/AgCl參比電極可以測(cè)量膠片沖洗液中的銀離子含量,。也可以將銀電極換成鉑或金電極進(jìn)行氧化還原電位的測(cè)量,。例如:某種金屬離子的氧化階段。
常用的pH指示電極是玻璃電極,。它是一支端部吹成泡狀的對(duì)于pH敏感的玻璃膜的玻璃,。管內(nèi)充填有含飽和AgCl的3mol/l kcl緩沖溶液,,pH值為7。存在于玻璃膜二面的反映pH值的電位差用Ag/AgCl傳導(dǎo)系統(tǒng)導(dǎo)出。
此電位差遵循能斯特公式:

能斯特公式
將E0,、R、T(298.15K即25℃)等數(shù)值代入上式既得:
E=59.16mv/25℃ per pH (式中已將ln(H3O+)轉(zhuǎn)化為pH)
式中R和F為常數(shù),,n為化合價(jià),,每種離子都有其固定的值。對(duì)于氫離子來講n=1,。溫度“T”做為變量,,在能斯特公式中起很大作用。隨著溫度的上升,,電位值將隨之增大,。
對(duì)于每1℃的溫度變大,將引起電位0.2mv/per pH變化,。用pH值來表示則每1℃第1pH變化0.0033pH值,。
這也就是說:對(duì)于20~30℃之間和7pH左右的測(cè)量不需要對(duì)溫度變化進(jìn)行補(bǔ)償;而對(duì)于溫度>30℃或<20℃和pH值>8pH或6pH的應(yīng)用場(chǎng)合則必須對(duì)溫度變化進(jìn)行補(bǔ)償,。
 您好, 歡迎來到化工儀器網(wǎng)
您好, 歡迎來到化工儀器網(wǎng)
