巴氏吸管由醫(yī)用級聚乙烯(PE)制成,,管體
基因治療行業(yè)深度報告:從癌癥到罕見遺傳病
| 導讀 | 從上世紀90年代興起的基因治療,,經(jīng)歷了20多年的起伏,又重新受到廣泛關(guān)注,。2017年,,伴隨著兩款CAR-T療法和Spark公司的基因治療產(chǎn)品在美國獲批,更被認為是“基因治療”之年,。本文將通過以下內(nèi)容,,詳細介紹基因治療在范圍內(nèi)的進展和前景。 |
部分:介紹基因治療的定義,、發(fā)展歷程,、主要的分類,包括體內(nèi)和體外基因療法,;
第二部分:詳細介紹基因治療在腫瘤領域的應用,,主要是通過體外基因改造、培養(yǎng)T細胞,,以CAR-T或TCR-T的形式,,重新回輸?shù)襟w內(nèi),攻擊癌細胞,。CAR-T技術(shù)目前相對成熟,,公司包括諾華、Kite等,;TCR-T在實力瘤領域被寄予厚望,,代表公司有Adaptimmune Therapeutics、Medigene等,;
第三部分:詳細介紹基因治療在罕見遺傳病領域的進展,,除了已獲批的Luxturna,,其他的基因治療產(chǎn)品包括:BioMarin針對血友病A的BMN270,AveXis針對脊髓型肌肉萎縮癥的AVXS-101等,;
第四部分:展示了我國基因治療發(fā)展現(xiàn)狀,,CAR-T技術(shù)關(guān)注度高,多家公司致力于該技術(shù)的研發(fā),,代表公司有南京傳奇,、恒潤達生、科濟生物,、博生吉等,。基因治療在罕見病領域的應用,,由于我國政策,、醫(yī)保覆蓋等原因,還處在比較早期的階段,。
第五部分:展望未來,,基因治療作為一種新興的生物科學技術(shù),尤其是伴隨著基因編輯技術(shù)的興起,,給癌癥以及罕見病患者帶來了新的希望,。在我國,面對著競爭日趨激烈的CAR-T領域,,創(chuàng)始人背景,、科研實力、技術(shù)路徑,、靶點的選擇,、CAR-T的質(zhì)量控制、工藝的穩(wěn)定性等多方面因素將決定未來誰有可能勝出,。
目錄
一,、基因治療的發(fā)展歷程和分類
1.1基因治療近三十年的發(fā)展歷程:從興起,低潮再到重新崛起
1.2基因編輯技術(shù)的進步助力基因治療
1.3基因治療的分類
二,、基因治療在癌癥領域的主要應用:CAR-T和TCR-T
2.1 CAR-T:腫瘤免疫治療的熱門技術(shù)
2.2 CAR-T療法的代表公司:諾華
2.3 TCR-T:有望在實體瘤領域突破的腫瘤免疫療法
2.4 TCR-T的代表公司:Adaptimmune Therapeutics
三,、基因治療在罕見病領域的應用:眼科、血友病,、神經(jīng)遺傳性疾病等
3.1基因治療在眼科領域的應用,,代表公司Spark
3.2基因治療在血友病領域的應用,代表公司:BioMarin
3.3基因治療在神經(jīng)遺傳性疾病的應用,,以及代表公司AveXis
3.4基因治療在其他罕見遺傳病領域的應用
四,、我國基因治療領域的發(fā)展
4.1 Car-T:我國基因治療的熱門領域
4.2我國基因治療在罕見病領域:起步較晚、進展較慢
五、總結(jié)和未來展望
一,、基因治療的發(fā)展歷程和分類
1.1基因治療近三十年的發(fā)展歷程:從興起,,低潮再到重新崛起
基因治療:廣義的基因治療包括所有糾正,、修復DNA缺陷的方法,,從而達到疾病治療的目的。早在上世紀90年代,,科學家們已開始這樣的嘗試,。上世紀90年代,四歲的阿香提患有重癥聯(lián)合免疫缺陷?。⊿CID),,這是一種因為腺苷脫氨酶的基因缺陷導致的免疫系統(tǒng)幾乎崩潰的罕見遺傳病。美國的安德森醫(yī)生和其他合作者,,從阿香提體內(nèi)提取白細胞,,將正常的腺苷脫氨酶導入這些細胞,然后把基因改造后的白細胞重新輸入病人體內(nèi),,手術(shù)后的阿香提體內(nèi)生產(chǎn)出了正常的腺苷脫氨酶,。
阿香提的成功案例點燃了人們對于基因治療的熱情,之后多個國家多個科學家迅速投入到基因治療的浪潮之中,,很多人認為基因治療的時代已經(jīng)來臨,,一直到1999年,18歲的杰西在一項基因治療臨床試驗中因為病毒載體引起的劇烈免疫反應不幸過世,,給科學家們敲響了警鐘,,讓人們重新審視基因治療這項技術(shù)。
在此之后,,基因治療又出現(xiàn)了幾例臨床試驗的失敗,,這些失敗讓基因治療陷入了低潮期。一直到近幾年病毒載體安全性和有效性的不斷改進,,基因編輯技術(shù)的興起等,,基因治療熱度漸升。
2017年,,更是被認為是基因治療的突破之年,,在這一年,兩款CAR-T產(chǎn)品問世,,同時來自Spark公司的具有跨時代意義的眼部罕見病基因治療產(chǎn)品Luxturna獲批在美國上市,。從范圍來看,目前獲批的基因治療產(chǎn)品主要有以下:
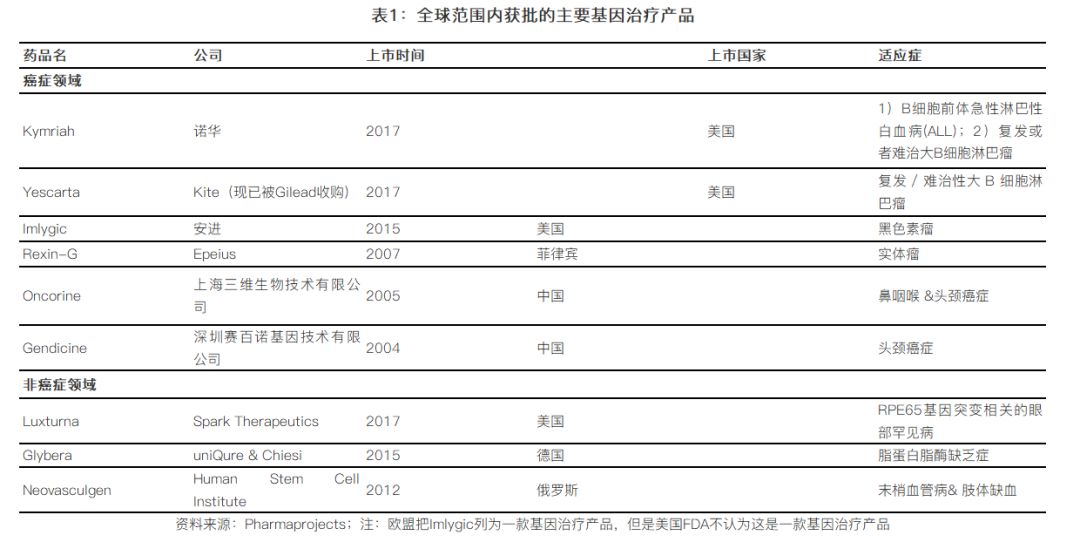
圖1:1995-2016年積極開發(fā)的基因治療項目的數(shù)量
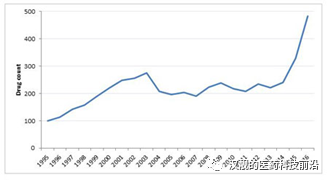
資料來源:Pharmaprojects(June 2016)
圖1展示了1995年-2016年之間積極開發(fā)的基因治療項目的數(shù)量,,從2012年左右,,積極開發(fā)的基因治療的項目數(shù)量呈指數(shù)級提升,并在2016年達到了約500例,由此可見基因治療行業(yè)經(jīng)歷了寒冬逐漸迎來曙光,,并且發(fā)展迅速,。
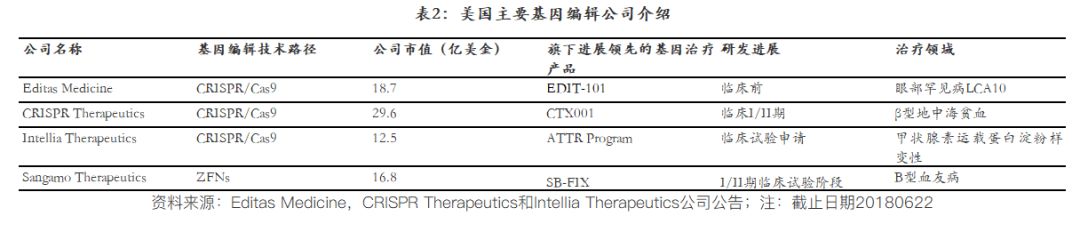
1.2 基因編輯技術(shù)的進步助力基因治療
基因編輯技術(shù)的突破也在一定程度上力推基因治療的發(fā)展,其中人工核酸內(nèi)切酶介導的基因組編輯技術(shù),,主要包括三種:ZFNs,、TALENs和CRISPR/Cas9技術(shù)。和傳統(tǒng)基因工程中的病毒載體相比,,基因編輯技術(shù)提供了一個的“手術(shù)刀”進行基因的增加,,減少以及修改。尤其是以CRISPR/Cas9技術(shù)為核心的三大基因編輯公司:Editas Medicine,,CRISPR Therapeutics和Inlia Therapeutics,,陸續(xù)登陸美股,且這三大基因編輯公司均致力于基因治療產(chǎn)品的研發(fā),,雖然目前還是在非常早期的階段,,但是給基因治療未來的發(fā)展帶來很多希望。
1.3 基因治療的分類
基因治療按照治療方式,,主要分為兩大類:
1)體內(nèi)基因治療(In Vivo Gene Therapy):直接向血液或者目標器官中注射攜帶所需基因的載體,。例如,Spark公司的Luxturna屬于該類型,;
2)體外基因治療(Ex Vivo GeneTherapy):把患者的細胞從體內(nèi)移出,,通過在體外對于細胞進行基因改造,重新輸入至患者的體內(nèi),,例如體外基因改造對造血干細胞,,以Bluebird在研的用于治療鐮刀型貧血癥的基因治療產(chǎn)品LentiGlobin為代表,或者對免疫T細胞的基因改造,,包括CAR-T,,TCR-T等。
基因治療按照治療領域分類,,又可以細分為癌癥,,單基因罕見遺傳病,心血管疾病,,傳染病等,。同時根據(jù)Pharmaprojects在2016年的報告,癌癥和罕見病是當前基因治療臨床研究多的兩個領域,,如下內(nèi)容將詳細介紹這兩個領域的基因治療現(xiàn)狀和前景,。
圖2:在研的基因治療數(shù)量(按照疾病分類)
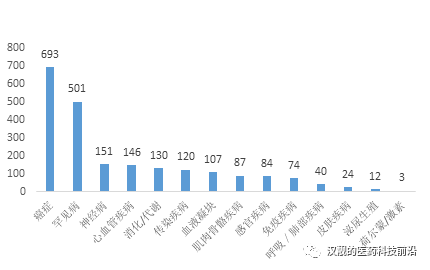
資料來源:Pharmaprojects(June 2016)
二、基因治療在癌癥領域的主要應用:
CAR-T和TCR-T
目前基因治療在腫瘤領域的應用,,主要是通過在體外基因改造T細胞,,通過CAR-T或者TCR-T的形式,再把基因改造后的T細胞回輸?shù)交颊唧w內(nèi),讓改造后的T細胞攻擊癌細胞,,從而達到治療腫瘤的目的,。
2.1 CAR-T:腫瘤免疫治療的熱門技術(shù)
CAR-T(ChimericAntigen Receptor T-Cell),中文全稱叫做嵌合抗原受體T細胞,。簡單地說,,是通過基因改造技術(shù),在T細胞(人體內(nèi)一種重要的免疫細胞)上加入一個嵌合抗原受體,,其主要是由胞外抗原結(jié)合區(qū),、跨膜鏈接區(qū)和胞內(nèi)信號區(qū)三個部分組合,,從而讓免疫T細胞不僅能夠特異性地識別癌癥細胞,,同時可以激活T細胞殺死癌癥細胞。CAR-T技術(shù)治療癌癥的過程,,主要是四個步驟:1)T細胞的收集,、活化;2) T細胞的體外基因轉(zhuǎn)導:通過基因工程技術(shù),,讓CAR嵌合到T細胞上,;3)構(gòu)建好的CAR-T細胞的體外增值培養(yǎng);4)CAR-T的回輸和患者的觀測,。
圖3:CAR-T細胞治療流程
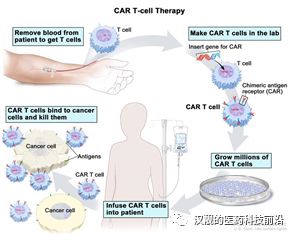
資料來源:National Cancer Institute
盡管CAR-T的理論由來已久,,上個世紀90年代就有科學家提出,但是在過去的幾年中,,CAR-T技術(shù)突飛猛進,,尤其是在2017年美國FDA批準了兩款CAR-T治療方案,分別是來自諾華和Kite(現(xiàn)在已經(jīng)被Gilead收購)的Kymriah和Yescarta(如表1),,除此之外,,還有多家公司致力于CAR-T領域,代表公司包括:Juno(現(xiàn)已被Celgene收購),、Bluebird,、Cellectis等。
2.2 CAR-T療法的代表公司:諾華
早在1999年,, Dr. Carl June和其團隊在賓夕法尼亞大學已展開CAR-T研究,。經(jīng)過了十幾年的努力,2012年,,諾華宣布和和賓夕法尼亞大學合作,,共同研發(fā)和商業(yè)化CAR-T免疫療法,其中就包括了CTL019:一款以CD19為靶點的CAR-T腫瘤免疫療法,。同時在2012年,,患有急性淋巴細胞白血病的美國7歲女孩艾米麗接受該CAR-T療法,成為了世界上首先接受CTL019治療的患者,艾米麗的癌癥至今也沒有再復發(fā),。
2017年8月,,諾華宣布CTL019(商品名:Kymriah)獲FDA批準用于25歲以下難治或者復發(fā)的B-細胞急性淋巴細胞白血病,也是款獲批上市的CAR-T,,其獲批主要是基于一項臨床多中心關(guān)鍵性臨床試驗數(shù)據(jù)(ELIANA Study),。
2018年1月,諾華更新了該試驗數(shù)據(jù),。結(jié)果顯示,,對于接受CAR-T治療的75名患者,在這之后的三個月或者更長時間的隨訪中,,Kymriah展現(xiàn)出了整體的總緩解率達到81%,。60%的患者達到了*緩解(CompleteResponse, CR),同時21%的患者達到了CR,,但血細胞計數(shù)恢復不*,。對于所有應答患者,沒有檢測出微小殘留病,,中位的隨訪時間是13.1個月,。
2018年5月,諾華批準了Kymriah用于成人復發(fā)或者難治的大B細胞淋巴瘤,,包括了非彌漫性大B細胞淋巴瘤,,以及高度的B細胞淋巴瘤。
2.3 TCR-T:有望在實體瘤領域突破的腫瘤免疫療法
TCR-T(T cell receptor-geneengineered T cells,,TCR-T),,中文全稱是T細胞受體基因工程改造T細胞:通過基因工程的手段,直接改造T細胞識別腫瘤抗原的表面受體:TCR(T cell receptor:T細胞受體),,從而加強T細胞識別和殺傷腫瘤細胞的能力,。
盡管和CAR-T療法一樣,同屬于腫瘤免疫治療,,也同樣是體外對T細胞進行基因改造的基因治療,。但是和CAR-T療法不同的地方在于:1)CAR-T療法是在T細胞上構(gòu)建一個嵌合型抗體受體,而TCR-T技術(shù)是改造T細胞的表面受體,,增強其親和性,;2)和CAR-T只能識別腫瘤細胞表面抗原不同,TCR-T可以靶向細胞內(nèi)或者細胞表面的腫瘤抗原,,從而讓TCR-T有了更多的靶點可供選擇,,尤其包括多個和癌癥相關(guān)的細胞內(nèi)抗原,這也是部分學者認為TCR-T在實力瘤領域具備巨大潛力的原因,。
例如,,腫瘤-睪丸抗原(Cancer-testis Antigen,,簡稱CTAs),是一類發(fā)現(xiàn)于多種腫瘤組織內(nèi),,但是正常細胞內(nèi)較少出現(xiàn)的細胞質(zhì)蛋白,,被認為和很多癌癥息息相關(guān),而這一類的抗原,,也成為了目前多款TCR-T療法的目標靶點,,包括NY-ESO-1, MAGE A4, MAGE A10等。
圖4:TCR-T和CAR-T的區(qū)別
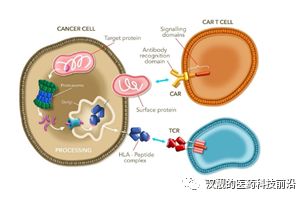
資料來源:Adaptimmune Therapeutics
當然,,TCR-T療法目前還存在不少挑戰(zhàn),,尚未有一款產(chǎn)品獲批,面對的困難包括:腫瘤微環(huán)境的抑制作用,,脫靶毒性,、神經(jīng)毒性,以及和CAR-T治療遇到的類似的CRS(細胞因子釋放綜合征)等等,。目前積極從事TCR-T療法開發(fā)的公司包括Adaptimmune,、Medigene,、Kite等,。
Adaptimmune Therapeutics是英國的一家生物醫(yī)藥公司,成立于2014年,,2015年登陸美國納斯達克,。公司的核心技術(shù)是其*的TCR-T技術(shù)平臺:SPEAR(Specific Peptide Enhanced Affinity Receptor)T細胞技術(shù),可以對特定抗原增強T細胞親和力,,該技術(shù)平臺的研發(fā)已有超過15年的歷史,。
圖5:TCR-T療法的步驟
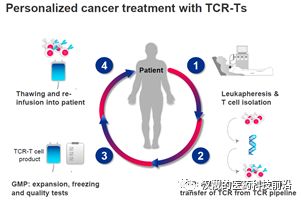
資料來源:Medigene
2.4 TCR-T的代表公司:Adaptimmune Therapeutics
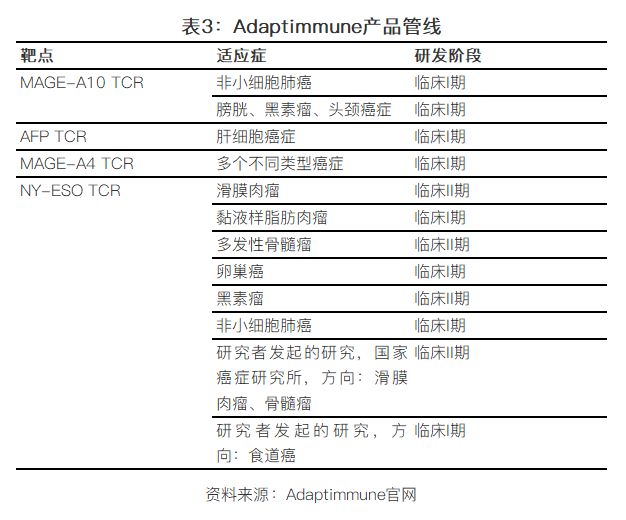
以該技術(shù)平臺為基礎,公司旗下有四款TCR-T治療產(chǎn)品在臨床階段,,分別以MAGE-A10, MAGE-A4, AFP 和 NY-ESO為靶點,,涉足多個腫瘤類型,包括實體瘤和血液瘤,。進度*的一款TCR-T療法:NY-ESO TCR,,已在多個癌癥領域中進行臨床試驗,包括血液瘤領域的多發(fā)性骨髓瘤,,實體瘤領域里的黑色素瘤,,卵巢癌,非小細胞肺癌,,滑膜肉瘤等,。不過根據(jù)之前的條款,這款產(chǎn)品的權(quán)利已經(jīng)授權(quán)給GSK,。
三,、基因治療在罕見病領域的應用:
眼科,、血友病、神經(jīng)遺傳性疾病等
確認的罕見病大約有7000多種,,但僅有幾百種罕見病擁有獲批的治療藥物,,基因治療在罕見病領域意義重大,因為超過80%的罕見病是由單基因缺陷引起(資料來源:NIH),。對于罕見病,,傳統(tǒng)小分子藥物,通常是通過減輕癥狀而發(fā)揮作用,,與此相反,,基因治療擁有糾正基因缺陷的潛能,尤其對于單基因罕見病,,提供一個潛在的治愈方案,,而不是簡單的管理癥狀。進一步來說,,成功的基因治療或許僅僅需要一次治療,,而不是終生的持續(xù)治療。
3.1基因治療在眼科領域的應用,,代表公司Spark
遺傳性視網(wǎng)膜病變(Inherited Retinal Diseases,,IRDs)是一組罕見的眼睛疾病,由遺傳性基因突變造成,,常會導致視力喪失或者失明,。IRDs又可以細分為視網(wǎng)膜色素變性(Retinitis Pigmentosa, RP),雷伯氏先天性黑曚(Leber Congenital Amaurosis,LCA),,先天性靜止性夜盲(Congenital Stationary Night Blindness,CSNB)等,。由于IRDs大多由單個基因缺陷引起(由單個基因缺陷導致的IRDs的發(fā)病率大約是1/3000),同時因為眼睛是人體內(nèi)相對獨立的,,容易進行治療的器官,,所以IRDs成為了基因治療的熱門研究領域。
以Spark公司為例,,該公司成立于2013年,,有超過20年的基因治療研究基礎,技術(shù)平臺來源于費城兒童醫(yī)院,,2015年初,,登陸美國納斯達克。Spark公司2017年獲批上市的Luxturna是一款用于治療RPE65基因缺陷的遺傳性視網(wǎng)膜病變,,只需要一次性治療,。其中,RPE65基因編碼的RPE65蛋白是我們的視覺系統(tǒng)中一種非常重要的酶,,可以催化11-順-視網(wǎng)膜(11-cis-retinal)異構(gòu)化成為全反式視黃醛(All-trans-retinal),,從而觸發(fā)光傳導通路(Phototransduction Pathway),,終讓大腦皮質(zhì)的視覺中樞產(chǎn)生視覺。Spark預計在全美以及歐洲主要五國的患者人數(shù)達到3500人,。
Spark的Luxturna是通過AAV病毒(腺病毒相關(guān)病毒)攜帶正常的RPE65基因,,進入到視網(wǎng)膜內(nèi),正常的RPE65基因并不整合到人體細胞的DNA中,,而是在細胞核中合成正常的RPE65蛋白,,從而幫助觸發(fā)光傳導通路,恢復正常的視覺功能,。當然,,除了Spark,Editas等其他公司的產(chǎn)品管線內(nèi)都有在研的針對IRDs的基因治療產(chǎn)品,。
3.2基因治療在血友病領域的應用,,代表公司:BioMarin
基因治療另外一個潛在的重要領域就是血友病。血友病主要包括血友病A和血友病B,,都屬于罕見的X染色體隱形遺傳病,,分別由于缺乏足夠的凝血因子VIII和凝血因子IX兩種蛋白,從而導致凝血功能異常,,發(fā)生持續(xù)性出血,,嚴重時可以影響生命。血友病聯(lián)盟預測有超過15萬人患有血友病A,,接近3萬人患有血友病B,。BioMarin、Spark,、Bioverative等公司都致力于研發(fā)血友病領域的基因治療產(chǎn)品,以下以BioMarin公司為例,。
BioMarin是一家美國上市的生物科技公司,,旗下的基因治療產(chǎn)品BMN270針對血友病A,和Spark一樣,,也是采用AAV病毒,,目前已經(jīng)進入臨床三期。在17年美國ASH會議上,,BioMarin公布了BMN270的新數(shù)據(jù),,表明:對于注射劑量在6e13vg/kg的7名患者,在接受治療的78周后,,凝血因子VIII水平的中位數(shù)和平均數(shù)分別達到90%和89%,,根據(jù)血友病聯(lián)盟的定義,正常人的凝血VIII因子的水平在50%-150%之間,。
同時,,數(shù)據(jù)顯示,,在接受治療的四周后,中位數(shù)的年化流血率(Annualized Bleeding Rate)以及凝血因子VIII的注射次數(shù)(Annualized FVIII Infusions)均為0,,代表了沒有出現(xiàn)流血現(xiàn)象和接受傳統(tǒng)的替代療法,。該數(shù)據(jù)非常正面,讓科研人員看到了基因治療在未來可以*治愈血友病的希望,。
3.3基因治療在神經(jīng)遺傳性疾病的應用,,代表公司AveXis
長久以來,基因治療在治療神經(jīng)系統(tǒng)疾病挑戰(zhàn)非常大,,困難包括病毒載體的安全性,,運送病毒載體的方式等。而如今,,以上兩個方面都取得了巨大的進步,。尤其是科學家們發(fā)現(xiàn)AAV9病毒載體的相對安全性和有效性,以及可以穿過血腦屏障(Blood–Brain Barrier, BBB),,成為了多個神經(jīng)系統(tǒng)疾病基因治療項目的優(yōu)選載體,,其中為代表的包括AveXis公司(已被諾華收購)。
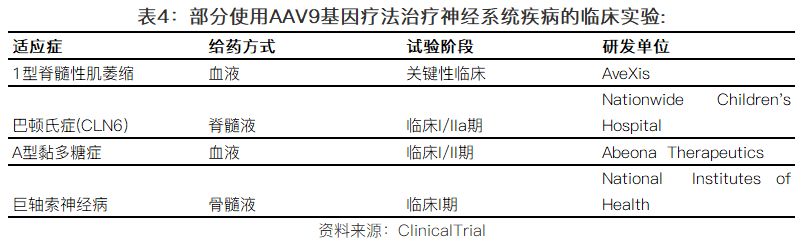
AveXis是美國的一家生物科技公司,,成立于2010年,,致力于開發(fā)罕見和致命的神經(jīng)遺傳疾病的基因治療產(chǎn)品,2016年登陸美國納斯達克,。公司的主要產(chǎn)品AVXS-101是一款在研的用于治療脊髓型肌肉萎縮癥(Spinal Muscular Atrophy,,又簡稱SMA)的基因治療產(chǎn)品。
SMA是一種嚴重的神經(jīng)肌肉疾病,,由SMN1基因缺陷所致,,發(fā)生率大約是每一萬個新生兒童中有一個例患有該疾病。在AVXS-101基因治療產(chǎn)品中,,AAV9病毒載體被用于攜帶正常工作的人類SMN基因并通過靜脈給藥,,被病毒攜帶進入細胞體內(nèi)的SMN基因,并不整合到細胞原有的DNA分子內(nèi),,而是通過轉(zhuǎn)錄和翻譯,,制造出合適水平的SMN蛋白。
AVXS-101已經(jīng)完成針對SMA一型患者的臨床一期試驗(公開標簽,、劑量爬坡,、用于衡量產(chǎn)品的安全性和耐受性),正在開展關(guān)鍵性臨床試驗(Pivotal Clinical Trial),。臨床I期試驗中,,共入組了15名SMA一型嬰兒患者,分為兩組,,一組是建議的劑量,,入組了12名患者,,一組是低劑量,入組了3名患者,。在嬰兒患者年齡達到13.6個月的時候,,無事件生存率(Event-free Survival)達到100%。而相對應的文獻數(shù)據(jù)顯示,,患者在13.6個月的時候,,無事件生存率僅為25%。截止臨床I期試驗結(jié)束,,對于建議劑量的12名入組患者,,中位年齡是20.2個月,有9名患者可以至少5秒鐘無需幫助的坐著,。此外,,該基因治療方案展示了良好的安全性和耐受性。
3.4基因治療在其他罕見遺傳病領域的應用
基因治療目前在研的罕見病還包括鐮刀型貧血癥,、Beta型地中海貧血癥,、脂蛋白酶缺乏癥、黏多糖貯積癥,、腎上腺腦白質(zhì)失養(yǎng)癥等,,除了我們上述提到的基因治療的公司,企業(yè)還包括Bluebird,,uniQure,、Sarepta、Tocagen等,。
四,、我國基因治療領域的發(fā)展
4.1 CAR-T:我國基因治療的熱門領域
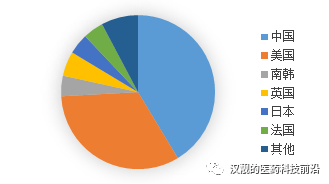
我國的基因治療目前主要是集中在CAR-T領域,從*的角度來看,,CAR-T研究的公司主要集中在中國和美國,,兩個國家從事CAR-T研究的公司占比超過80%。
圖6:CAR-T公司地理分布
資料來源:Celltrials
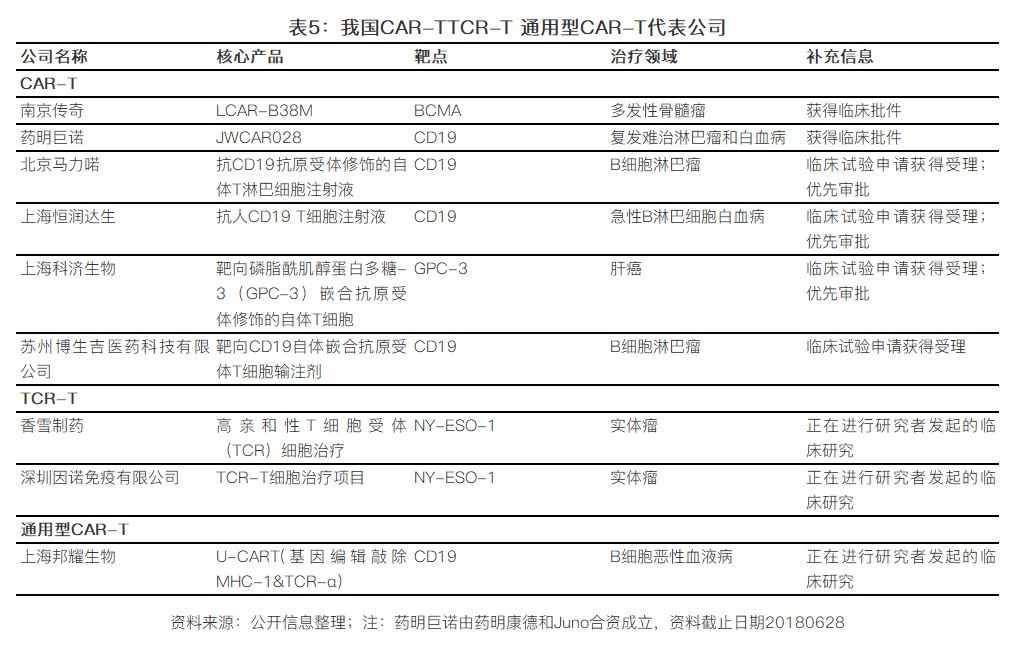
2016年12月,,原CFDA(現(xiàn)在改名為:國家藥品監(jiān)督管理局,SDA)頒布《細胞制品研究與評價技術(shù)指導原則》,,旨在規(guī)范和指導細胞治療產(chǎn)品,,并在2017年底正式推出《細胞治療產(chǎn)品研究與評價技術(shù)指導原則(試行)》,按照藥品研發(fā)以及管理規(guī)范對CAR-T等細胞治療產(chǎn)品進行監(jiān)管,,明確CAR-T等細胞治療產(chǎn)品的申報原則,。同時,南京傳奇生物的LCAR-B38M已經(jīng)成功搶得國內(nèi)CAR-T臨床批件,。除了南京傳奇生物,,我國從事CAR-T療法的公司還包括優(yōu)卡迪生物,、北京馬力喏、恒潤達生,、博生吉等,,不過大部分還是集中在血液瘤領域,多以CD19和BCMA為靶點,,布局實力瘤的包括科濟生物等,。與此同時,在監(jiān)管層面,,我國細胞治療產(chǎn)業(yè)也開始走向正規(guī),。早在2009年,免疫細胞療法作為第三類醫(yī)療技術(shù)進行管理,,后在2015年7月衛(wèi)計委決定取消第三類醫(yī)療技術(shù)臨床應用準入審批,。2016年的“魏則西事件”震驚全國,反應了我國在該領域一直存在著監(jiān)管不嚴,,亂象叢生的現(xiàn)狀,。
和趨勢一樣,我國從事TCR-T研發(fā)的公司較少,,主要有香雪,、因諾生物等公司致力于TCR-T技術(shù)的研發(fā)。另外,,我國也已有公司開始把基因編輯技術(shù)應用到構(gòu)建“通用型CAR-T”的研發(fā)過程中,,例如上海邦耀生物, 但是還處在非常早期的階段,。
4.2我國基因治療在罕見病領域:起步較晚,、進展較慢
和美國基因治療技術(shù)逐漸應用于罕見病不同,我國在罕見病領域的發(fā)展起步較晚,,進展較慢,,不利因素包括市場需求低、患者人數(shù)少,、醫(yī)保難以支付等問題,。
但值得欣慰的是,一方面,,國家政策對于罕見病的重視程度逐漸加大,,在今年五月份,國家衛(wèi)生健康委員會等五部門聯(lián)合制定了《批罕見病目錄》,,包含了121種罕見病,。另一方面,也可以看到我國有機構(gòu)開始涉足罕見病的基因治療領域,例如北京瑞希罕見病基因治療技術(shù)研究所,,雖然還是屬于一個非盈利的科研單位,,但致力于基因療法在罕見病領域的應用,目前旗下兩款在研藥物,,分別是針對SMA和粘多糖貯積癥III A型,。
五、總結(jié)和未來展望
綜上所述,,基因治療行業(yè)經(jīng)過20多年的摸索,,目前正處在高速發(fā)展期。在癌癥領域,,對于T細胞的體外基因改造,,以CAR-T形式對血液瘤的治療取得的進展快,2017年分別來自諾華和Kite的兩款CAR-T獲美國FDA批準,,具有里程碑的意義,。TCR-T作為另外一種備受關(guān)注的癌癥領域的基因療法,目前在實力瘤的應用被寄予厚望,,代表公司包括英國的AdaptimmuneTherapeutics,、德國的 Medigene等,不過還有待臨床試驗的進一步驗證,。
至于基因治療在罕見遺傳病領域的發(fā)展,,欣喜地看到美國FDA已經(jīng)批準了Spark公司針對眼部罕見病的Luxturna,同時基因治療在血友病,、神經(jīng)系統(tǒng)疾病,、鐮刀型貧血癥等多個罕見遺傳都呈現(xiàn)積極的進展,公司包括BioMarin,、AveXis,、Bluebird等等。以CRISPR/Cas9為核心的基因編輯技術(shù)的興起,,美國三大基因編輯公司Editas Medicine,、CRISPR Therapeutics和Inlia Therapeutics陸續(xù)登陸美股,更讓基因治療打開新的篇章,。
我國基因治療領域,,CAR-T是目前很受關(guān)注,也是資本,、科研等集中力量投入的方向,,尤其是我國細胞治療產(chǎn)業(yè),經(jīng)歷了之前不規(guī)范的不利影響,,已逐漸走上正規(guī),多家公司,包括南京傳奇,、科濟生物,、優(yōu)卡迪、博生吉,、恒潤達生等都已按照藥物批準流程,,申報臨床試驗,且南京傳奇在多發(fā)性骨髓瘤領域的LCAR-B38M已獲得臨床批件,。
面對國內(nèi)競爭日益激烈的CAR-T領域,,未來誰會勝出,需要關(guān)注的因素包括創(chuàng)始人背景,、科研實力,、技術(shù)路徑、靶點的選擇,、CAR-T的質(zhì)量控制,、工藝的穩(wěn)定性等等。另外,,我國基因治療在TCR-T,、罕見病等其他領域還處在比較早期的階段,還需要科研數(shù)據(jù)的進一步驗證,,但也是目前值得關(guān)注的方向,。總之,,無論國外還是國內(nèi),,基因治療作為一種新型的生物技術(shù)療法,給眾多患者帶來了的治療手段,,帶來了新的希望,。(轉(zhuǎn)化醫(yī)學網(wǎng))
 您好, 歡迎來到化工儀器網(wǎng)
您好, 歡迎來到化工儀器網(wǎng)

 12
12


