聯(lián)系電話
- 聯(lián)系人:
- 菲羅門
- 電話:
- 020-22826668
- 手機:
- 售后:
- 020-22826668
- 傳真:
- 020-28098130
- 地址:
- 廣州市天河北路179號尚層國際13樓
- 網(wǎng)址:
- www.gzflm.com
掃一掃訪問手機商鋪
蛋白質(zhì)純化
RP-HPLC 是一種有效的蛋白質(zhì)/多肽純化工具,。
通過 RP-HPLC 法可以從雜質(zhì)中分離目標蛋白/多肽,,采集到的片段可用于進一步研究,,以及借助正交分析技術(shù)的分析,,甚至可作為治療藥物,。
在蛋白質(zhì)/多肽分析過程中,,色譜條件優(yōu)化的目標是優(yōu)化分辨率和保留時間,。
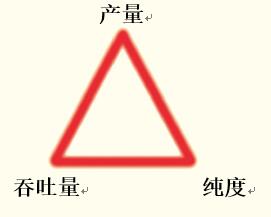
制備色譜法分離蛋白質(zhì)/多肽時,,色譜條件的開發(fā)主要是三個參數(shù)的優(yōu)化(參見圖45):
產(chǎn)量是從色譜法每一步中得到的純化的目標蛋白/多肽含量。高產(chǎn)量可提高純化過程的實用性,,并降低成本,。
純度是從目標產(chǎn)物中去除雜質(zhì)的程度。純度高有助于從后續(xù)分析中獲得更佳的數(shù)據(jù)或獲得高純度產(chǎn)物。
通量用來衡量制備周期中純化的物質(zhì)量,。高通量說明在給定的成本和時間內(nèi)獲得更多研究或分析用物質(zhì),,或更多原料藥,用于制藥領(lǐng)域,。
由于制備色譜的目的與分析色譜的目的不同,,因此色譜條件優(yōu)化也不同。
圖45. 在蛋白質(zhì)或多肽的制備純化中,,通過尋求產(chǎn)量,、純度及通量的蕞佳平衡實現(xiàn)分離條件的優(yōu)化。
樣品裝載
在分析色譜中,,將小樣品裝載到色譜柱上以確保加樣量不影響分辨率,。
如果樣品量過高,則峰會加寬,,進而分辨率會下降,。
在不發(fā)生峰展寬的情況下允許加載到色譜柱的樣品量(“樣品容量”)取決于柱的大小(附錄列表顯示了柱的大小和樣品容量),。
制備色譜法純化蛋白質(zhì)/多肽時,,通常會超出樣品容量,使柱“過載”,,從而增加產(chǎn)量和通量(圖46),。
當(dāng)允許一定的分辨率損失時,加載的樣品量可為樣品容量的10~50倍(附錄,,大實際負載),。
圖46中,盡管由于柱過載使得峰變寬,,但峰形相對較好,,說明嚴重過載在增加產(chǎn)量的同時還能保持純度,但目標蛋白/多肽的損失不可避免,。
由于樣品過載,,圖47中峰也同樣加寬。
片段收集,、分析和利用
當(dāng)柱過載時,,通常會拋棄起始峰和結(jié)尾峰。
圖46中,,對紅色區(qū)標示的峰的中間區(qū)域進行了收集,。去掉了峰首和峰尾。
這避免了分離度較差的雜質(zhì)峰的收集,,增加了純度,,但降低了產(chǎn)量,。
在制備色譜中,對幾種感興趣的峰進行了片段收集,,用于雜質(zhì)分析,。
圖46.在多肽純化示例中,制備分離包括柱的過載加樣,,以增加產(chǎn)量,。
分辨率降低,為了增加純度必須拋棄峰首和峰尾,,但產(chǎn)量稍微有所降低,。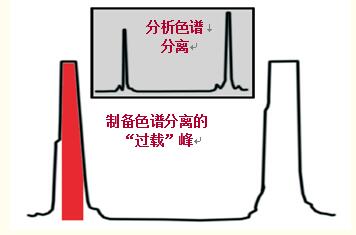
基于分析結(jié)果,收集了少雜質(zhì)或無雜質(zhì)的片段,,拋棄了峰首和峰尾附近雜質(zhì)較多的片段,。
收集和拋棄片段的選擇應(yīng)考慮純度和產(chǎn)量的平衡,。
例如,,在不損失分辨率的情況下,4.6 x 250 mm的“分析”柱可用于純化少量多肽(多約200微克),。
但為了增加產(chǎn)量和通量,,同樣大小的柱多可純化10毫克,但會有一定的純度或產(chǎn)量損失,。
恰當(dāng)?shù)氖占暹x擇有助于實現(xiàn)純度和產(chǎn)量間的蕞佳平衡,。
在制備色譜中,盡管重點在樣品質(zhì)量,,但樣品體積也可能會很大,。
盡管可采用樣品環(huán)和注射器,但通過將樣品“泵”至柱上可以注入更多樣品,。
將泵的吸入管置于樣品容器內(nèi),,樣品通過洗脫泵加載至色譜柱。
當(dāng)有機溶劑濃度低(通常,,樣品裝在水相中)且目的蛋白/多肽以有機溶劑梯度洗脫時,,可通過這種方式裝入大量樣品。
吸附劑粒徑
分析色譜常用的吸附劑粒徑為5μm,,制備色譜常用的吸附劑粒徑更大,。
尤其是加樣量超過樣品容量時(柱過載),柱效較分析色譜影響較小,。
當(dāng)柱過載時,,大粒徑填充柱同小粒徑填充柱分離蛋白質(zhì)和多肽的效果一樣。
因此,,制備色譜常用10μm或以上粒徑的吸附劑,。粒徑分布也往往更寬,。
不同于0.5μm或更窄的粒徑分布范圍,制備色譜的粒徑范圍更大,,例如10~15μm,。
由于制備色譜柱反壓和成本更低,因此更傾向于采用大粒子,。
柱內(nèi)徑
由于樣品容量很低,,純化過程很少使用小孔柱(內(nèi)徑小于2mm)。
小規(guī)模實驗室純化采用細孔柱(內(nèi)徑約2mm)和分析柱(4.6 mm內(nèi)徑),。
這種小規(guī)模制備分離的色譜條件通常與分析分離的色譜條件相同,。
需要大量蛋白質(zhì)/多肽時,采用10mm和22mm內(nèi)徑的柱子,。
1 mg蛋白質(zhì)或多肽的純化可采用10 mm柱子,,5 mg純化可采用22 mm柱子。
允許柱過載時,,可純化更多蛋白質(zhì)/多肽,,10mm柱多可純化50mg,22mm柱多可純化200mg,。
大量蛋白質(zhì)或多肽的純化采用50 mm,、100 mm或內(nèi)徑更大的大內(nèi)徑柱子。
50mm內(nèi)徑的柱上已知多可純化5克蛋白質(zhì)/多肽,。
柱長
與分析柱相比,,制備柱往往相對較短。
這是因為在制備色譜法中,,柱的總體積比柱長更重要,,特別是蛋白質(zhì)的分離。
內(nèi)徑60cm,、柱長12-15 cm(“圓餅狀”柱)的色譜柱已應(yīng)用到蛋白質(zhì)治療藥物的大規(guī)模純化中,。
由于在制備色譜法中,柱通常過載,,且效益的重要性遠不及產(chǎn)量,、純度及通量重要,因此根據(jù)其實用性而非效益優(yōu)化柱尺寸,。
流動相組成
同分析色譜法一樣,,采用10~22mm內(nèi)徑柱的小規(guī)模純化常用乙腈-TFA體系。
大規(guī)模純化通常采用乙醇等溶劑替代乙腈,,采用乙酸替代TFA,。
盡管采用這些溶劑作流動相會降低分辨率,但它們更適合大規(guī)模使用,,且分辨率的降低與柱過載固有的分辨率損失相同
蛋白質(zhì)變性
通常認為反相色譜法會使蛋白質(zhì)變性,,因此洗脫出來的蛋白質(zhì)不是天然蛋白,,且可能不具備生物活性。
盡管反相HPLC的操作條件會使蛋白質(zhì)變性,,但洗脫后仍可獲得天然,、具有生物活性的蛋白質(zhì)。
有機溶劑可能減弱疏水力,,造成蛋白質(zhì)三級結(jié)構(gòu)的損失,。吸附劑的疏水面也可能導(dǎo)致蛋白質(zhì)的去折疊。
但與色譜分離時間相比,,蛋白質(zhì)去折疊通常較慢,,且蛋白質(zhì)在反相色譜分離期間僅發(fā)生輕微變性。
由于二硫鍵的作用,,蛋白質(zhì)保持球形結(jié)構(gòu),,且僅發(fā)生部分去折疊,因此從反相柱洗脫出的蛋白質(zhì)通??赏ㄟ^在恰當(dāng)?shù)闹卣郫B緩沖液中處理,,從而恢復(fù)其天然結(jié)構(gòu)而恢復(fù)至天然狀態(tài)。
目前有許多實例均顯示采用反相HPLC純化后的蛋白仍維持天然三級結(jié)構(gòu)和生物活性,。
胰蛋白酶的反相純化,,其中活性得到了保留,且隨后用于蛋白質(zhì)的胰蛋白酶酶切,。
重組人紅細胞生成素是一種成功商業(yè)化的蛋白質(zhì)治療藥物,采用了反相液相色譜法將蛋白藥物從其細胞培養(yǎng)表達系統(tǒng)中分離出來,。
采用反相HPLC對另一種商業(yè)蛋白質(zhì)治療藥物——粒細胞刺激因子進行了純化,。
此外,還采用反相HPLC對重組人胰島素進行了純化,,維持了活性結(jié)構(gòu),。
純化實例
圖47顯示了合成肽——促性腺激素釋放激素(GnRH)拮抗劑的純化過程。該純化過程通過以下幾個步驟展開:
在4.6 x 250 mm 的分析柱上構(gòu)建洗脫條件,。
在50 x 300 mm 的柱上裝載1.2克合成肽混合物,,基于步構(gòu)建的條件洗脫(圖47)。
對 GnRH 拮抗劑各洗脫峰的片段進行收集并借助分析法分析,,終實現(xiàn)高產(chǎn)量和純度,。
用乙腈和TFA作為洗脫劑,在反相色譜柱上再次進行色譜分析,完成收集到片段的脫鹽處理,。
收集片段實現(xiàn)高產(chǎn)量和純度,。
在該色譜純化步驟中,從1.2 gm的反應(yīng)混合液中可收集128 mg的純化肽,。
該純化過程采用了與分析色譜分離相同的有機溶劑——乙腈,,但采用磷酸三乙胺替代了TFA,。
由于柱過載,洗脫峰更寬,,分辨率不如分析色譜,。但峰仍然較為緊密,且容易收集到含目的多肽和GnRH的洗脫液,。
圖47. 128mg的合成肽——促性腺激素釋放激素的純化,。
柱嚴重過載,導(dǎo)致峰非常寬,。
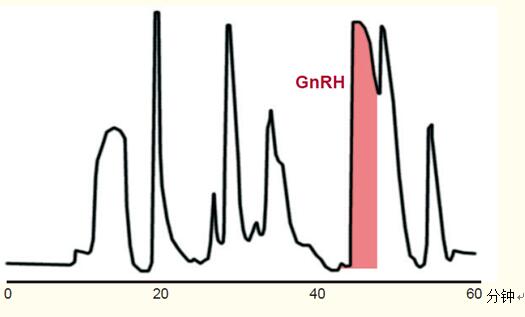
條件
色譜柱:C18寬孔柱,,15~20μm粒徑,50 x 300 mm,。
流動相:乙腈和磷酸三乙胺水溶液梯度洗脫,。
樣品:促性腺激素釋放激素

 初級會員·11年
初級會員·11年
