凡是需要做分子生物學(xué)實(shí)驗(yàn)的lab,,肯定逃不了要買一臺核酸定量的機(jī)器。目前流行的儀器是Nanodrop One,,只需滴加一兩微升的樣品,,按一下按鈕,利用核酸的紫外吸收特性,,即可得到濃度數(shù)據(jù),。近幾年,以Qubit 4為代表的基于特異熒光染料法的儀器也逐漸進(jìn)入科研人員的視野,。那么,,這兩類儀器有什么區(qū)別,在使用時需要注意什么,,如何根據(jù)實(shí)驗(yàn)室需求來選購,?且聽老司機(jī)分解。
首先我們需要來理解兩臺儀器在核酸定量原理上的區(qū)別,。正如方才所言,,Nanodrop One利用了核酸的紫外吸收特性。

(圖1:Nanodrop One)
核酸,,包括DNA和RNA,,均由核糖,、磷酸基以及堿基構(gòu)成。其中,,由于堿基含有芳香環(huán)結(jié)構(gòu),,因此具有紫外吸收的特性。核酸的特征吸收波長為260 nm,。根據(jù)朗伯比爾定律,,已知物質(zhì)的消光系數(shù)(幾十年前早已測量),液層的厚度(固定的樣品室),,就能利用其吸光度來計算出物質(zhì)的濃度,。與此同時,還能通過計算A260/A280和A260/A230的數(shù)值,,估計核酸的純度,。(280 nm吸光通常來自蛋白質(zhì),而230 nm則通常來自糖類和苯酚等,。)
而Qubit 4這一類儀器采用的是熒光染料法,。這些熒光染料可以特異地與不同種類的核酸鏈相結(jié)合,并在特定波長光源的激發(fā)下,,發(fā)出熒光,。其中,結(jié)合了核酸的熒光染料,,相比那些游離的,,信號可增幅數(shù)十倍至數(shù)百倍,因此可以和背景區(qū)分開來,。目前,,做測序的實(shí)驗(yàn)室基本把Qubit 4當(dāng)標(biāo)配儀器了。

(圖2:Qubit 4.0)
雖然以Nanodrop One為代表的紫外吸收法在科研領(lǐng)域已經(jīng)沿用了數(shù)十年,,但由于原理上的限制,,這一類儀器有無法避免的缺陷。
1,、紫外吸收法無法區(qū)分DNA和RNA
這一點(diǎn)其實(shí)在原理上就很好理解了,。如下圖所示,具有紫外吸收的結(jié)構(gòu)是核酸的堿基,,而DNA和RNA均含有堿基,,因此當(dāng)一份樣品同時含有DNA和RNA的時候,無論你本意是想測哪一個,,均會高估其真實(shí)濃度。
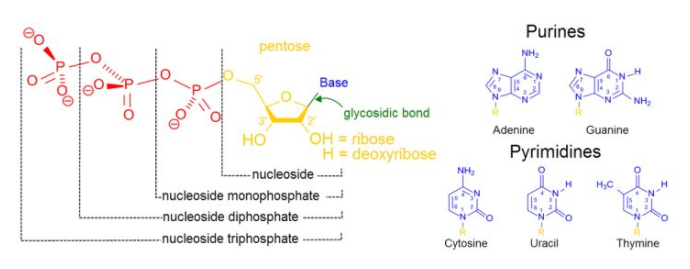
(圖3:核酸的結(jié)構(gòu))
而Qubit 4的熒光染料法則避免了這個問題,。只要采用DNA,、RNA特異的染料,,就能有選擇性地測定樣品中的核酸濃度。下圖是Qubit 4的*測試數(shù)據(jù),。這個實(shí)驗(yàn)是在DNA樣品中混合入不同比例的RNA,,并用Qubit 法和紫外吸收法分別進(jìn)行測定。當(dāng)DNA的樣品足夠純時(DNA:RNA = 10:0),,兩種方法測得的數(shù)值并沒有顯著區(qū)別,。但當(dāng)混入的RNA越來越多,紫外吸收的數(shù)值也跟著升高(藍(lán)色和綠色柱子),,而使用雙鏈DNA染料的Qubit數(shù)值則沒有改變(紅色柱子),。使用RNA染料用Qubit 4進(jìn)行測定,則會發(fā)現(xiàn),,隨著RNA混入的增加,,讀數(shù)也跟著升高。
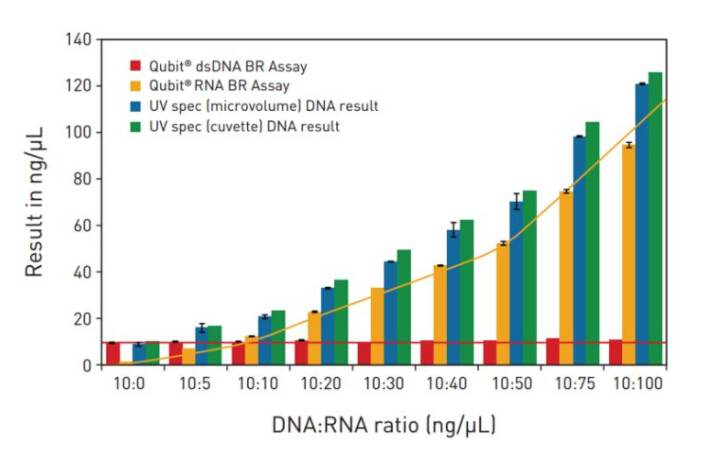
(圖4:Qubit和紫外吸收法對DNA-RNA混合樣品的測定)
目前,,雙鏈和單鏈DNA,、RNA及蛋白質(zhì)均有特異的熒光染料。也就是說,,無需專門純化樣品,,或者在未知污染程度的情況下,使用Qubit可以方便地得知濃度信息,。
2,、紫外吸收法的定量限較高
記得有一次做實(shí)驗(yàn),放了0.5 µg質(zhì)粒做酶切,,跑膠回收于30 µl的溶液中,,然后做Nanodrop測定濃度,后數(shù)值約為25 ng/µl……
于是本司機(jī)得到的結(jié)論是:我們實(shí)驗(yàn)室的那臺Nanodrop一定是內(nèi)置了賢者之石(霧——) 還是去隔壁借用一下Qubit吧,。
其實(shí)是這樣的,,對于任何儀器分析,我們都應(yīng)該去理解其檢出限和定量限,。Nanodrop標(biāo)稱的檢出限是2 ng/µl(雙鏈DNA),,然而定量限則遠(yuǎn)高于此。其他的Nanodrop one用戶也有類似的體驗(yàn),,曾經(jīng)在ResearchGate上看到說,,低于50 ng/µl的話就容易測不準(zhǔn),變異度會增大,。以下同樣是來自Qubit的*數(shù)據(jù),。當(dāng)DNA的濃度低于某個程度時,紫外吸收法的偏差和變異度就突破天際了,。

(圖5:Qubit與紫外吸收法測定低濃度DNA時的偏差及變異度比較)
這兩張圖中,,紫外吸收法得到的偏差和變異度在我看來已經(jīng)算小的了(不能搞太大啊,,不然沒人買怎么辦?數(shù)據(jù)來自Thermo Fisher公司,,但他們家兩類儀器都有,,手心手背都是肉),要低于4 ng/µl雙鏈DNA才會亂飆車,。然而在實(shí)際使用中,,低于10甚至20 ng/µl時就比較容易出亂子。而PCR產(chǎn)物膠回收等應(yīng)用,,終的實(shí)際濃度往往就落在這個容易測不準(zhǔn)的范圍內(nèi),。雖然這對老司機(jī)們來說還不至于把下游實(shí)驗(yàn)搞砸,但測不準(zhǔn)還是很郁悶的,。
3,、紫外吸收法對溶液的pH和鹽濃度敏感
在研究物質(zhì)吸光度時,我們總要明確地定義緩沖液的離子強(qiáng)度以及pH,,這就說明,,吸光度本身是受到這兩個因素影響的。
通常而言,,偏酸的溶液,,容易給出偏低的A260/A280數(shù)值。相反,,偏堿的溶液則容易高估,。相應(yīng)地,也有報道稱,,當(dāng)用水作為溶劑時,,紫外吸收測定的數(shù)值變異度增大,而當(dāng)使用Tris或Tris-EDTA溶液進(jìn)行測定時,,重復(fù)性就提高了,。這其中的原因,很可能是空氣中溶解入水中的CO2濃度差異造成的,。離子強(qiáng)度對于紫外吸收的影響比較復(fù)雜,,這里不展開。
相比之下,,熒光染料法對樣品的污染和pH等的容忍度較大,。
4、紫外吸收法對降解比較嚴(yán)重的核酸無能為力
這一點(diǎn),,同樣也是由紫外吸收原理的局限性所決定的,。紫外吸收測定的對象是堿基,因此無論核酸是完整成鏈的,還是降解成單個游離核苷酸,,該方法均無法加以區(qū)分,。盡管我們可以通過A260/A280數(shù)值是否過大來估計核酸樣品的降解狀況,但卻無法選擇性地只測定那些結(jié)構(gòu)完整的核酸的濃度,。
而熒光染料通常結(jié)合的是核酸的鏈結(jié)構(gòu),并不會與游離的單核苷酸相互作用,。不過話說回來,,對于那些尚未降解成單個核苷酸而呈短鏈狀態(tài)的核酸,熒光染料法是無法將其與完整核酸區(qū)分開來的,。
[咚咚咚,!敲黑板!]
但是,,紫外吸收法也不是一味的爛,,熒光染料法也不是說吊打(大面積吊打還是做得到)。
如果在實(shí)驗(yàn)中獲得的核酸樣品總是很純凈且均一(如原材料是容易對付的培養(yǎng)細(xì)胞,,還用品質(zhì)好的試劑盒進(jìn)行抽提,;而非奇奇怪怪的樣品,還要是自己配的試劑),,同時產(chǎn)量又很高,,那紫外吸收法*可以勝任,外加測定速度熒光染料法,。此外,,熒光染料法對溫度比較敏感,比如上一回是在25℃室溫制作并儲存的標(biāo)準(zhǔn)曲線,,而這一回要測定樣品時實(shí)驗(yàn)室空調(diào)壞掉,,一下子有了3℃以上的溫差,那么標(biāo)曲就得重新制作,。同時,,熒光染料要現(xiàn)用現(xiàn)配,樣品至少要染2 min,,花費(fèi)的時間比紫外吸收法要長,。
以下用一張表總結(jié)兩者的優(yōu)劣。請根據(jù)自己的實(shí)際情況斟酌,。










