當(dāng)前位置:河南榮程聯(lián)合科技有限公司>>技術(shù)文章>>解鎖單細(xì)胞空間蛋白組學(xué)分析技能
解鎖單細(xì)胞空間蛋白組學(xué)分析技能
前言
/
在當(dāng)今這個(gè)科研節(jié)奏飛快的時(shí)代,,想要把科學(xué)論點(diǎn)高調(diào)地發(fā)表在頂級(jí)期刊上往往需要運(yùn)用多種技術(shù)采集“立體而豐滿(mǎn)"的結(jié)果作為論據(jù)支持,。以組織樣本為例,要實(shí)現(xiàn)單細(xì)胞分析,,我們很容易會(huì)想到流式細(xì)胞術(shù)(Flow cytometry),。在此基礎(chǔ)上進(jìn)行空間定位分析,免疫組化(Immunohistochemistry)的優(yōu)勢(shì)則非常明顯,。而說(shuō)到蛋白組學(xué)分析,,質(zhì)譜分析法(Mass spectrometry)無(wú)疑是最“接地氣"的手段。喜愛(ài)高效率的我們不禁會(huì)問(wèn):“有沒(méi)有一個(gè)技術(shù)能綜合單細(xì)胞,、空間定位和蛋白組學(xué)分析的優(yōu)點(diǎn)呢,?" 這時(shí),徠卡人會(huì)自豪地告訴你:“Cell DIVETM了解一下~" 接下來(lái),,讓我們結(jié)合實(shí)際應(yīng)用,,看看Cell DIVETM在單細(xì)胞,、空間定位和蛋白組學(xué)分析方面的優(yōu)勢(shì),。
小鼠腸道簇狀細(xì)胞單細(xì)胞分析
通過(guò)成像手段實(shí)現(xiàn)單細(xì)胞分析的最大難點(diǎn)在于如何實(shí)現(xiàn)單一樣本的多色標(biāo)記。傳統(tǒng)熒光免疫組化技術(shù)受到熒光染料光學(xué)特征的限制,,難以完成一個(gè)樣本內(nèi)超過(guò)7種生物標(biāo)志分子的成像任務(wù),。Cell DIVETM技術(shù)通過(guò)多輪染色的手段克服了該難題,可以在一個(gè)樣本內(nèi)實(shí)現(xiàn)多于60種生物標(biāo)志物的成像檢測(cè),。配合病理分析軟件,,可以輕松地完成每個(gè)細(xì)胞內(nèi)各種生物標(biāo)志分子的半定量分析。
下面這篇文章就是我們美國(guó)范德比爾特大學(xué)醫(yī)學(xué)中心(Vanderbilt University Medical Center)的客戶(hù)用Cell DIVETM完成的小鼠小腸簇狀細(xì)胞(Tuft cells)14種生物標(biāo)志物的成像和異質(zhì)性分析[1],。簇狀細(xì)胞,,也叫做多吞飲小管細(xì)胞 (Caveolated cells),是一種分布于胃腸道的罕見(jiàn)細(xì)胞類(lèi)型,,約占所有腸上皮細(xì)胞的0.4%,,其頂端呈現(xiàn)密集的微絲結(jié)構(gòu),并在化學(xué)傳感(Chemosensing)中發(fā)揮作用,。
作者通過(guò)功能性蛋白檢測(cè)不僅發(fā)現(xiàn)了小腸簇狀細(xì)胞的數(shù)量,、組成和功能受飲食和腸道菌群調(diào)控的規(guī)律,還發(fā)現(xiàn)了Hopx和p-EGFR高表達(dá)的兩個(gè)新簇狀細(xì)胞亞群,,為腸道簇狀細(xì)胞的進(jìn)一步研究提供了基礎(chǔ)框架,。在本研究中,Cell DIVETM發(fā)揮了強(qiáng)大的單細(xì)胞分析能力,,幫助作者完成簇狀細(xì)胞的精確定位和功能性分子表達(dá)量分析(圖2),。
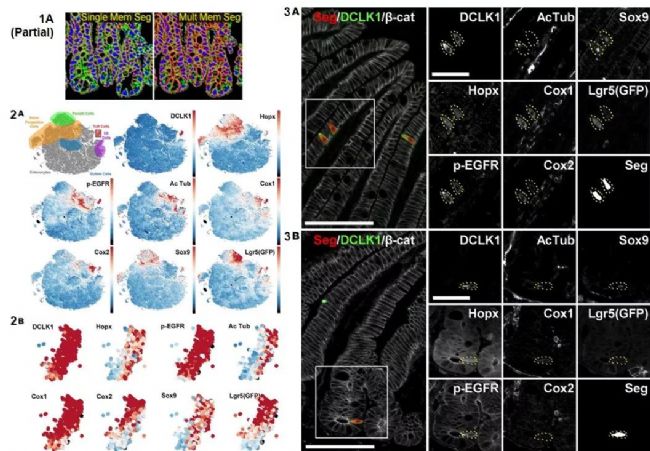
圖2 小鼠簇狀細(xì)胞(Tuft cells)超多標(biāo)成像-分析圖 [1]
(1A)細(xì)胞圈選分割示意圖,(2A & B)細(xì)胞群體t-SNE分析及簇狀細(xì)胞異質(zhì)性分析,(3)簇狀細(xì)胞功能性分子熒光成像圖,。
腫瘤-免疫細(xì)胞空間定位分析
分子空間定位信息的呈現(xiàn)是顯微成像技術(shù)的傳統(tǒng)優(yōu)勢(shì),,但難以對(duì)成像數(shù)據(jù)進(jìn)行深度信息挖掘,導(dǎo)致圖像往往只能作為文章結(jié)論的“助攻"型結(jié)果,。作為一套整體解決方案,,Cell DIVETM結(jié)合了當(dāng)今定量病理分析行業(yè)的金標(biāo)準(zhǔn)——HALO軟件(圖3),使圖像深層信息的呈現(xiàn)不再遙不可及,。單細(xì)胞生物標(biāo)志物定量,、組織區(qū)域AI智能識(shí)別、細(xì)胞密度/浸潤(rùn)/距離分析等HALO最擅長(zhǎng)的分析方式能輕松解碼超多標(biāo)圖像的隱藏信息,。

圖3 HALO定量病理分析示意圖
接下來(lái),,我們通過(guò)一篇由美國(guó)梅奧診所(Mayo Clinic)的客戶(hù)發(fā)表的惡性黑色素瘤微環(huán)境研究的文章來(lái)看看Cell DIVETM強(qiáng)大的空間定位分析能力[2]。腫瘤微環(huán)境中腫瘤細(xì)胞和免疫細(xì)胞的相互作用關(guān)系對(duì)研究腫瘤免疫應(yīng)答具有重要意義,。
作者用Cell DIVETM技術(shù)對(duì)173例III期惡性黑色素瘤病人臨床樣本中21種生物標(biāo)志分子進(jìn)行成像(圖4),,進(jìn)而通過(guò)分析多個(gè)免疫細(xì)胞亞群的浸潤(rùn)特征,找到?jīng)Q定異質(zhì)性腫瘤微環(huán)境中淋巴細(xì)胞浸潤(rùn)的關(guān)鍵因素——高表達(dá)HLA-1的腫瘤細(xì)胞,。在本研究中,,Cell DIVETM展現(xiàn)了優(yōu)秀的批量數(shù)據(jù)處理和空間定位分析能力,幫助作者完成不同HLA表達(dá)水平的腫瘤細(xì)胞與淋巴細(xì)胞的精準(zhǔn)定位分析(圖4-6A),。
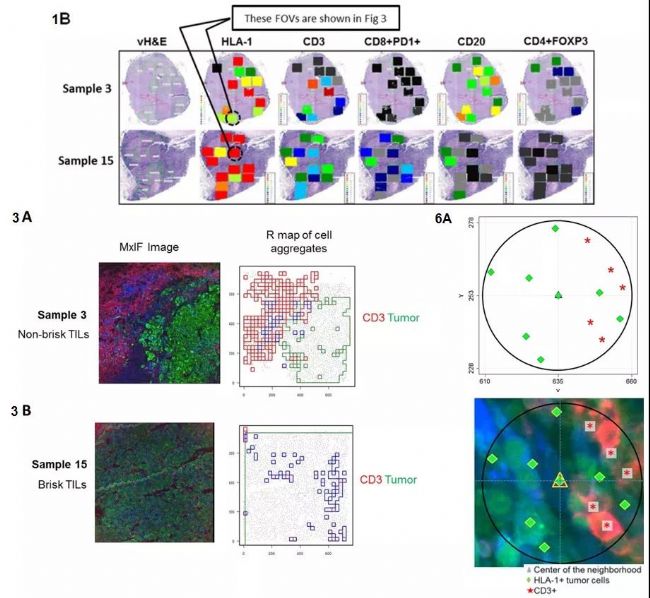
圖4 黑色素腫瘤微環(huán)境中免疫細(xì)胞空間定位分析圖 [2]
(1B)腫瘤病人淋巴結(jié)分區(qū)視野選擇示意圖,,熱圖顯示所選視野標(biāo)記分子表達(dá)差異,(3A & B)腫瘤微環(huán)境中淋巴細(xì)胞浸潤(rùn)密度分析,,(6A)免疫細(xì)胞空間定位分析,。
結(jié)腸癌MAPK信號(hào)通路蛋白組學(xué)分析
技術(shù)研發(fā)初期,Cell DIVETM之所以選擇多輪抗體標(biāo)記路線(xiàn)的原因之一是為了突破單一樣品中檢測(cè)生物標(biāo)志分子的數(shù)量限制,。作為一種理論上沒(méi)有標(biāo)記上限的實(shí)驗(yàn)手段,,多輪抗體標(biāo)記法可以更好地滿(mǎn)足后續(xù)蛋白組學(xué)分析在標(biāo)志分子數(shù)量上的需求。
為了更高效地進(jìn)行實(shí)驗(yàn)設(shè)計(jì),,Cell DIVETM研發(fā)團(tuán)隊(duì)在技術(shù)研發(fā)的同時(shí),,進(jìn)行了抗體庫(kù)的建立。目前,,已經(jīng)完成了350余種特異性抗體的Cell DIVETM技術(shù)兼容性測(cè)試,。不僅如此,我們還根據(jù)多個(gè)領(lǐng)域內(nèi)著名的生信數(shù)據(jù)庫(kù)(如KEGG PATHWAY等)將抗體按照不同研究方向進(jìn)行歸類(lèi),。用戶(hù)可以在抗體庫(kù)內(nèi)根據(jù)自己感興趣的研究方向查找關(guān)鍵蛋白,,極大地提高了實(shí)驗(yàn)設(shè)計(jì)環(huán)節(jié)中抗體選擇的效率(圖5)。

圖5 腫瘤研究Cell DIVETM已驗(yàn)證抗體數(shù)(部分)
Cell DIVETM研發(fā)時(shí)期的一篇文章向我們展現(xiàn)了上述的抗體資源庫(kù)在腫瘤病理分型方面具有優(yōu)勢(shì)[3],。為了優(yōu)化結(jié)直腸癌病理分型系統(tǒng),,作者利用抗體資源中的一系列生物標(biāo)志物對(duì)747例I至III期結(jié)直腸癌樣本進(jìn)行了Cell DIVETM單細(xì)胞空間蛋白組學(xué)分析,。針對(duì)不同生理事件和關(guān)注的信號(hào)通路,作者選取了細(xì)胞應(yīng)激,、細(xì)胞外基質(zhì),、調(diào)節(jié)蛋白和激酶等61種生物標(biāo)志分子。
通過(guò)蛋白組學(xué)分析,,作者發(fā)現(xiàn)mTORC1通路上游蛋白R(shí)PS6,、4E-BP1和ERK1/2的磷酸化程度有望作為判斷結(jié)直腸癌病人雷帕霉素耐藥的關(guān)鍵指標(biāo)(圖6)。這里不得不表?yè)P(yáng)一下Cell DIVETM抗體測(cè)試團(tuán)隊(duì),,完成了大量的抗體驗(yàn)證工作,,幫助Cell DIVETM用戶(hù)在實(shí)驗(yàn)設(shè)計(jì)環(huán)節(jié)節(jié)約了不少抗體信息檢索的時(shí)間。
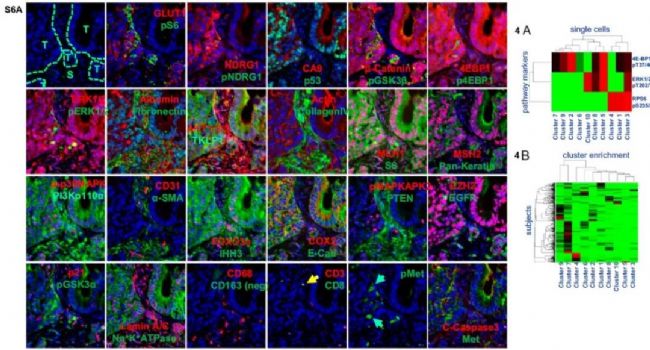
圖6 結(jié)直腸癌Cell DIVETM檢測(cè)和蛋白組學(xué)分析 [3]
結(jié)語(yǔ)
作為一套整體解決方案,,Cell DIVETM涵蓋了從實(shí)驗(yàn)設(shè)計(jì)到圖像采集再到結(jié)果分析的全套標(biāo)準(zhǔn)化操作流程,、優(yōu)秀的成像設(shè)備和強(qiáng)大的數(shù)據(jù)解析系統(tǒng),幫助用戶(hù)輕松實(shí)現(xiàn)超多標(biāo)(>10種標(biāo)記分子)成像,,解鎖單細(xì)胞空間蛋白組學(xué)分析技能,。

圖7 Cell DIVETM 超多標(biāo)組織成像分析整體解決方案
參考文獻(xiàn):
[1] Eliot McKinley, et al. Optimized multiplex immunofluorescence single-cell analysis reveals tuft cell heterogeneity. JCI Insight. 2017, 2(11): e93487
[2] Yan Yiyi, et al. Understanding heterogeneous tumor microenvironment in metastatic melanoma. PLoS ONE. 2019, 14(6): e0216485
[3] Gerdes MJ, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. PNAS, 2013, 110(29): 11982–11987



會(huì)員.png) 16
16
